Номер 1, страница 158 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 7. Металлы. Параграф 44. Магний. Щелочноземельные металлы. Подумай, ответь, выполни... - номер 1, страница 158.
№1 (с. 158)
Условие. №1 (с. 158)
скриншот условия

1. На основе положения в периодической таблице и представлений о строении атомов поясните, какие свойства магния и кальция являются общими. Составьте уравнения соответствующих реакций.
Решение. №1 (с. 158)

Решение 2. №1 (с. 158)
Решение
Для определения общих свойств магния ($Mg$) и кальция ($Ca$) обратимся к их положению в Периодической системе химических элементов Д. И. Менделеева и строению их атомов.
1. Положение в периодической таблице и строение атомов.
Магний ($Mg$) — химический элемент с порядковым номером 12. Он расположен в 3-м периоде, главной подгруппе II группы (IIA).
Кальций ($Ca$) — химический элемент с порядковым номером 20. Он расположен в 4-м периоде, главной подгруппе II группы (IIA).
Оба элемента находятся в одной группе, что указывает на сходство их химических свойств.
Рассмотрим электронное строение их атомов:
Атом магния ($_{12}Mg$) имеет заряд ядра +12 и 12 электронов, распределенных по трем электронным слоям: $1s^22s^22p^63s^2$. На внешнем (третьем) энергетическом уровне находятся 2 электрона ($3s^2$).
Атом кальция ($_{20}Ca$) имеет заряд ядра +20 и 20 электронов, распределенных по четырем электронным слоям: $1s^22s^22p^63s^23p^64s^2$. На внешнем (четвертом) энергетическом уровне также находятся 2 электрона ($4s^2$).
Общим для атомов магния и кальция является наличие двух электронов на внешнем энергетическом уровне. Эти электроны являются валентными.
2. Общие химические свойства.
Наличие двух валентных электронов определяет общие химические свойства магния и кальция. Они являются типичными металлами и сильными восстановителями. В химических реакциях они легко отдают свои два валентных электрона, превращаясь в положительно заряженные ионы $Mg^{2+}$ и $Ca^{2+}$, и проявляют постоянную степень окисления +2.
Общими для магния и кальция являются следующие реакции:
а) Взаимодействие с неметаллами.
Оба металла активно реагируют с кислородом при нагревании, образуя оксиды:
$2Mg + O_2 \rightarrow 2MgO$ (оксид магния)
$2Ca + O_2 \rightarrow 2CaO$ (оксид кальция)
Они также реагируют с галогенами, например, с хлором:
$Mg + Cl_2 \rightarrow MgCl_2$ (хлорид магния)
$Ca + Cl_2 \rightarrow CaCl_2$ (хлорид кальция)
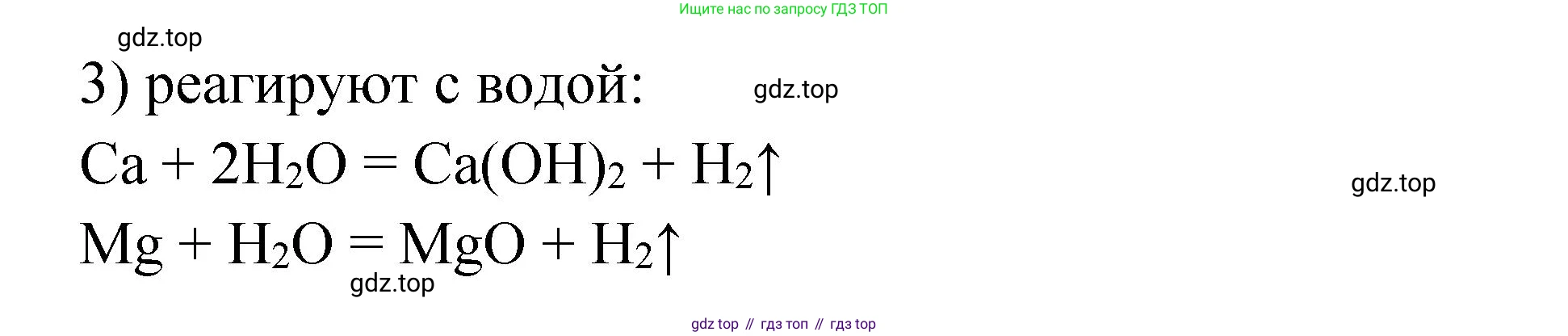
б) Взаимодействие с водой.
Оба металла реагируют с водой, вытесняя водород и образуя гидроксиды. Однако реакционная способность кальция выше, чем у магния. Кальций реагирует с холодной водой, а магний — только с горячей водой или паром:
$Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2 \uparrow$
$Mg + 2H_2O \xrightarrow{t^\circ} Mg(OH)_2 \downarrow + H_2 \uparrow$
в) Взаимодействие с кислотами.
Как активные металлы, стоящие в ряду активности до водорода, они реагируют с растворами кислот (кроме азотной и концентрированной серной), вытесняя водород и образуя соль:
$Mg + 2HCl \rightarrow MgCl_2 + H_2 \uparrow$
$Ca + 2HCl \rightarrow CaCl_2 + H_2 \uparrow$
г) Свойства оксидов и гидроксидов.
Их оксиды ($MgO$, $CaO$) являются основными, а гидроксиды ($Mg(OH)_2$, $Ca(OH)_2$) — основаниями.
Ответ: Общими свойствами магния и кальция, обусловленными их принадлежностью к главной подгруппе II группы периодической таблицы и наличием двух валентных электронов на внешнем слое, являются:
- Они — типичные металлы и сильные восстановители.
- В соединениях проявляют постоянную степень окисления +2.
- Реагируют с неметаллами (кислородом, галогенами), водой и кислотами с образованием соединений схожего типа.
Уравнения соответствующих реакций:
1. С кислородом:
$2Mg + O_2 \rightarrow 2MgO$
$2Ca + O_2 \rightarrow 2CaO$
2. С водой:
$Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2 \uparrow$
$Mg + 2H_2O \xrightarrow{t^\circ} Mg(OH)_2 \downarrow + H_2 \uparrow$
3. С соляной кислотой:
$Mg + 2HCl \rightarrow MgCl_2 + H_2 \uparrow$
$Ca + 2HCl \rightarrow CaCl_2 + H_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 158 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 158), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















