Номер 140, страница 270 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 10. Строение вещества. 10.2. Строение молекул. Химическая связь. Уровень 2 - номер 140, страница 270.
№140 (с. 270)
Условие. №140 (с. 270)


10.140. В таблице приведены энергии гомоядерных связей различной кратности между атомами элементов VA группы.
| Элемент | Энергия связи, кДж/моль | ||
| Э-Э | Э=Э | ||
| N | 159 | 310 | 945 |
| P | 200 | 270 | 490 |
| As | 167 | 240 | 400 |
а) Объясните возрастание энергии одинарной связи при переходе от N к Р.
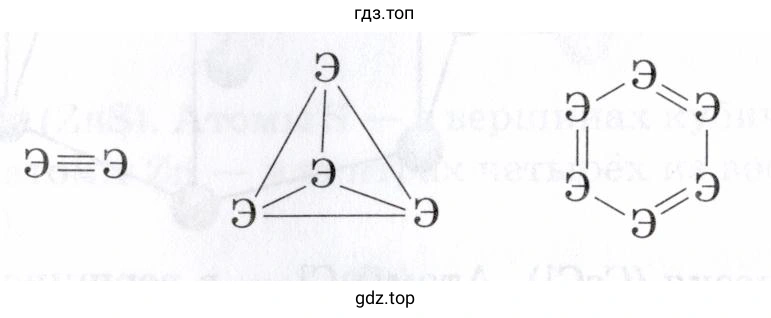
б) Используя данные таблицы, определите, какая из молекулярных форм для каждого элемента, приведённых на рисунке ниже, является наиболее устойчивой, т. е. обладает наименьшей энергией в расчёте на один моль атомов Э.
Решение 3. №140 (с. 270)
a) Возрастание энергии одинарной связи при переходе от азота (N) к фосфору (P) является аномалией, поскольку в общем случае энергия связи уменьшается вниз по группе с увеличением атомного радиуса. Это объясняется следующим образом:
Атом азота имеет очень малый ковалентный радиус. При образовании простой связи N-N два атома азота сближаются, и их неподеленные электронные пары оказываются в непосредственной близости друг от друга. Это приводит к сильному межэлектронному отталкиванию, которое значительно дестабилизирует и ослабляет одинарную связь N-N. Поэтому ее энергия (159 кДж/моль) аномально низка.
Атом фосфора имеет значительно больший радиус. В молекуле с одинарной связью P-P атомы находятся на большем расстоянии, и отталкивание между неподеленными электронными парами гораздо слабее. В данном случае этот эффект оказывается более значимым, чем общее ослабление связи из-за увеличения ее длины. В результате связь P-P (200 кДж/моль) оказывается прочнее связи N-N. При дальнейшем переходе к мышьяку (As) уже преобладает обычная тенденция: атом становится еще больше, связь длиннее и слабее, поэтому энергия связи As-As (167 кДж/моль) меньше, чем у P-P.
Ответ: Энергия одинарной связи N-N аномально низка из-за сильного отталкивания неподеленных электронных пар на соседних, очень маленьких по размеру атомах азота. У более крупного атома фосфора этот эффект отталкивания выражен значительно слабее, что и приводит к большей энергии связи P-P по сравнению с N-N.
б) Дано:
- $E(N-N) = 159$
- $E(N=N) = 310$
- $E(N≡N) = 945$
- $E(P-P) = 200$
- $E(P=P) = 270$
- $E(P≡P) = 490$
- $E(As-As) = 167$
- $E(As=As) = 240$
- $E(As≡As) = 400$
Найти:
Наиболее устойчивую молекулярную форму (Э₂, Э₄ или Э₆) для каждого элемента (N, P, As).
Решение:
Наиболее устойчивой является та форма, которая обладает наименьшей потенциальной энергией в расчете на один моль атомов. Это соответствует максимальной суммарной энергии всех связей в молекуле в расчете на один атом, так как образование связей сопровождается выделением энергии. Рассчитаем эту величину (удельную энергию связи, $E_{уд}$) для каждой из предложенных структур.
1. Двухатомная молекула Э₂ со структурой Э≡Э. Содержит одну тройную связь на два атома.
$E_{уд}(Э_2) = E(Э≡Э) / 2$
2. Тетраэдрическая молекула Э₄. Содержит 6 одинарных связей на четыре атома.
$E_{уд}(Э_4) = (6 \times E(Э-Э)) / 4 = 1.5 \times E(Э-Э)$
3. Шестичленная циклическая молекула Э₆. Содержит 3 одинарные и 3 двойные связи на шесть атомов.
$E_{уд}(Э_6) = (3 \times E(Э-Э) + 3 \times E(Э=Э)) / 6 = 0.5 \times (E(Э-Э) + E(Э=Э))$
Проведем расчеты для каждого элемента:
Азот (N)
- $E_{уд}(N_2) = 945 / 2 = 472.5$ кДж/моль атомов
- $E_{уд}(N_4) = 1.5 \times 159 = 238.5$ кДж/моль атомов
- $E_{уд}(N_6) = 0.5 \times (159 + 310) = 0.5 \times 469 = 234.5$ кДж/моль атомов
Сравнивая значения ($472.5 > 238.5 > 234.5$), заключаем, что для азота наиболее устойчивой является форма N₂.
Фосфор (P)
- $E_{уд}(P_2) = 490 / 2 = 245$ кДж/моль атомов
- $E_{уд}(P_4) = 1.5 \times 200 = 300$ кДж/моль атомов
- $E_{уд}(P_6) = 0.5 \times (200 + 270) = 0.5 \times 470 = 235$ кДж/моль атомов
Сравнивая значения ($300 > 245 > 235$), заключаем, что для фосфора наиболее устойчивой является форма P₄.
Мышьяк (As)
- $E_{уд}(As_2) = 400 / 2 = 200$ кДж/моль атомов
- $E_{уд}(As_4) = 1.5 \times 167 = 250.5$ кДж/моль атомов
- $E_{уд}(As_6) = 0.5 \times (167 + 240) = 0.5 \times 407 = 203.5$ кДж/моль атомов
Сравнивая значения ($250.5 > 203.5 > 200$), заключаем, что для мышьяка наиболее устойчивой является форма As₄.
Ответ: На основе данных таблицы, наиболее устойчивыми формами являются: для азота - двухатомная молекула Э₂ (структура Э≡Э), для фосфора и мышьяка - тетраэдрическая молекула Э₄.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 140 расположенного на странице 270 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №140 (с. 270), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















