Номер 3, страница 14 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава I. Теория химического строения органических соединений. Природа химических связей. Параграф 3. Практическая работа 1. Качественное определение углерода, водорода и хлора в органических веществах. Вопросы в параграфе - номер 3, страница 14.
№3 (с. 14)
Условие. №3 (с. 14)
скриншот условия

3. Отчёт о работе оформите в виде таблицы.
Что делали (названия опытов, рисунки приборов с обозначениями)
Что наблюдали (ваши наблюдения и соответствующие уравнения реакций)
Выводы
Решение. №3 (с. 14)
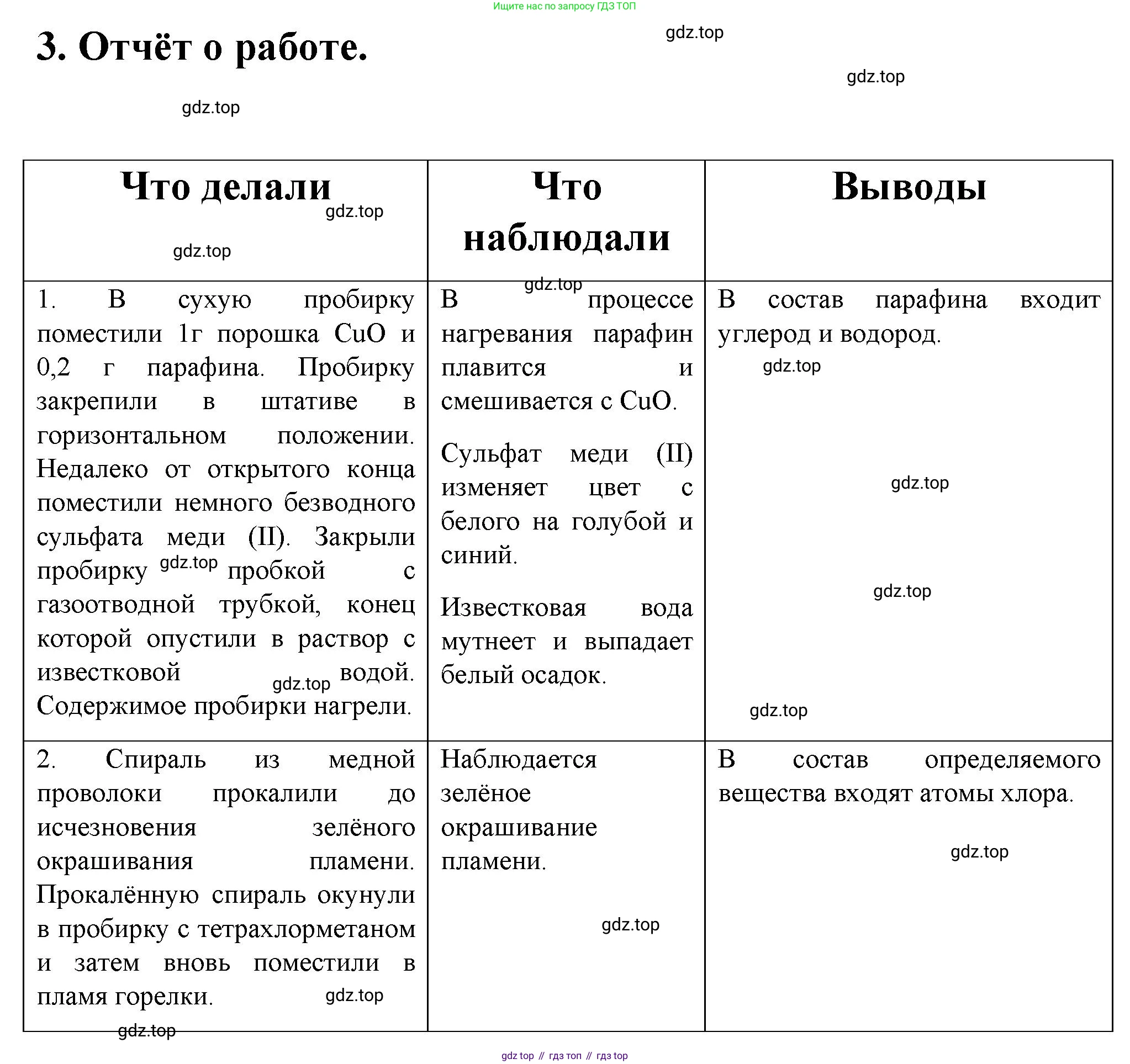
Решение 2. №3 (с. 14)
| Что делали (названия опытов, рисунки приборов с обозначениями) | Что наблюдали (ваши наблюдения и соответствующие уравнения реакций) | Выводы |
|---|---|---|
| Опыт 1. Получение водорода взаимодействием цинка с соляной кислотой. В химическую пробирку (1) поместили одну гранулу цинка (2). Затем в пробирку осторожно прилили 2-3 мл раствора соляной кислоты (3). Схема прибора: пробирка, содержащая гранулу металла и раствор кислоты. | Наблюдалось бурное выделение пузырьков бесцветного газа. Гранула цинка начала постепенно растворяться. Пробирка в ходе реакции заметно нагрелась. Уравнение реакции: $Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$ | Металлы, стоящие в электрохимическом ряду напряжений до водорода (например, цинк), способны вытеснять водород из растворов кислот-неокислителей (например, соляной). Реакция является экзотермической, так как протекает с выделением тепла. Ответ: В результате реакции замещения между цинком и соляной кислотой образуются соль хлорид цинка и газообразный водород. |
| Опыт 2. Получение и термическое разложение гидроксида меди(II). Этап 1: Получение. В пробирку налили 2 мл раствора сульфата меди(II) ($CuSO_4$) и по каплям добавили раствор гидроксида натрия ($NaOH$) до образования отчётливого осадка. Этап 2: Разложение. Пробирку с полученным осадком закрепили в держателе и осторожно нагрели в пламени спиртовки. Схема прибора: на первом этапе — пробирка с растворами; на втором этапе — пробирка с осадком, закрепленная в держателе и нагреваемая спиртовкой. | На этапе 1 наблюдалось выпадение студенистого осадка ярко-синего цвета. Уравнение реакции ионного обмена: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + Na_2SO_4$ На этапе 2 при нагревании синий осадок изменил цвет на чёрный. На холодных стенках пробирки сконденсировались капельки прозрачной жидкости (воды). Уравнение реакции разложения: $Cu(OH)_2 \xrightarrow{t^\circ} CuO + H_2O$ | Взаимодействие растворимой соли меди(II) со щёлочью приводит к образованию нерастворимого основания — гидроксида меди(II), что является качественной реакцией на ион $Cu^{2+}$. Гидроксид меди(II) является термически неустойчивым и при нагревании разлагается на оксид меди(II) чёрного цвета и воду. Ответ: Гидроксид меди(II) синего цвета получен реакцией обмена и при нагревании разлагается на чёрный оксид меди(II) и воду. |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 3 расположенного на странице 14 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 14), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















