Номер 16, страница 79 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 16. Аммиак и соли аммония - номер 16, страница 79.
№16 (с. 79)
Условие. №16 (с. 79)
скриншот условия


16. Литий нагрели в атмосфере азота. Образовавшееся твёрдое вещество растворили в соляной кислоте и на полученный раствор подействовали избытком щёлочи при нагревании. Выделившийся газ пропустили через раствор фосфорной кислоты. Напишите уравнения всех реакций.
Решение. №16 (с. 79)

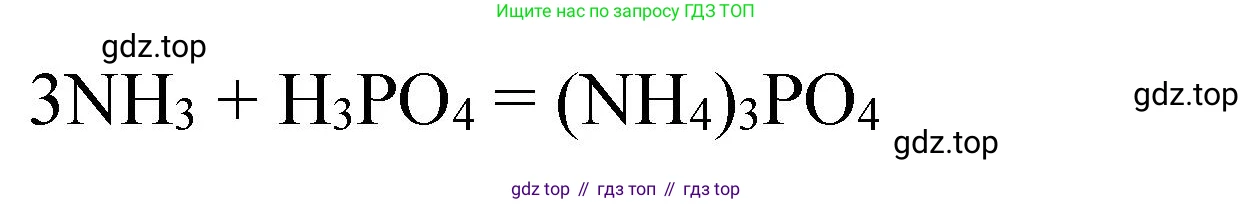
Решение 2. №16 (с. 79)
Решение
Процесс, описанный в задаче, включает в себя четыре последовательные химические реакции.
1. Нагревание лития в атмосфере азота
Литий — активный щелочной металл, который, в отличие от других металлов своей группы, реагирует с азотом воздуха при нагревании, образуя твёрдое вещество — нитрид лития.
$6Li + N_2 \xrightarrow{t} 2Li_3N$
2. Растворение образовавшегося твёрдого вещества в соляной кислоте
Нитрид лития ($Li_3N$) является солью, образованной сильным основанием ($LiOH$) и очень слабой кислотой (аммиак $NH_3$). При взаимодействии с сильной соляной кислотой ($HCl$) происходит реакция, в результате которой образуются хлорид лития и хлорид аммония.
$Li_3N + 4HCl \rightarrow 3LiCl + NH_4Cl$
3. Действие избытка щёлочи на полученный раствор при нагревании
Полученный раствор содержит хлорид лития ($LiCl$) и хлорид аммония ($NH_4Cl$). Хлорид аммония — соль, образованная слабым основанием ($NH_3$) и сильной кислотой ($HCl$). При добавлении к раствору избытка сильного основания (щёлочи, например, гидроксида натрия $NaOH$) и нагревании, слабое основание (аммиак) вытесняется из соли в виде газа.
$NH_4Cl + NaOH \xrightarrow{t} NaCl + H_2O + NH_3\uparrow$
4. Пропускание выделившегося газа через раствор фосфорной кислоты
Выделившийся газ — это аммиак ($NH_3$), который проявляет основные свойства. При его пропускании через раствор трёхосновной фосфорной кислоты ($H_3PO_4$) происходит реакция нейтрализации. В зависимости от соотношения реагентов могут образовываться кислые или средние соли:
- Дигидрофосфат аммония: $NH_3 + H_3PO_4 \rightarrow NH_4H_2PO_4$
- Гидрофосфат аммония: $2NH_3 + H_3PO_4 \rightarrow (NH_4)_2HPO_4$
- Фосфат аммония: $3NH_3 + H_3PO_4 \rightarrow (NH_4)_3PO_4$
Так как в условии не указано соотношение реагентов, допустимо записать уравнение образования любой из этих солей. Чаще всего в таких случаях записывают реакцию образования гидрофосфата или дигидрофосфата аммония. Запишем реакцию образования гидрофосфата аммония.
$2NH_3 + H_3PO_4 \rightarrow (NH_4)_2HPO_4$
Ответ:
$6Li + N_2 \xrightarrow{t} 2Li_3N$
$Li_3N + 4HCl \rightarrow 3LiCl + NH_4Cl$
$NH_4Cl + NaOH \xrightarrow{t} NaCl + H_2O + NH_3\uparrow$
$2NH_3 + H_3PO_4 \rightarrow (NH_4)_2HPO_4$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 16 расположенного на странице 79 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №16 (с. 79), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















