Номер 8, страница 313 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 6. Теоретическое описание химических реакций. Параграф 66. Ионное произведение воды. Водородный показатель - номер 8, страница 313.
№8 (с. 313)
Условие. №8 (с. 313)
скриншот условия

8. К 500 мл $2 \cdot 10^{-3}$-молярного раствора NaOH добавили $1,2 \cdot 10^{-2}$ г неизвестной щёлочи. pH полученного раствора равен 11,48. Считая, что процесс смещения происходит без изменения объёма, установите формулу щёлочи.
Решение. №8 (с. 313)

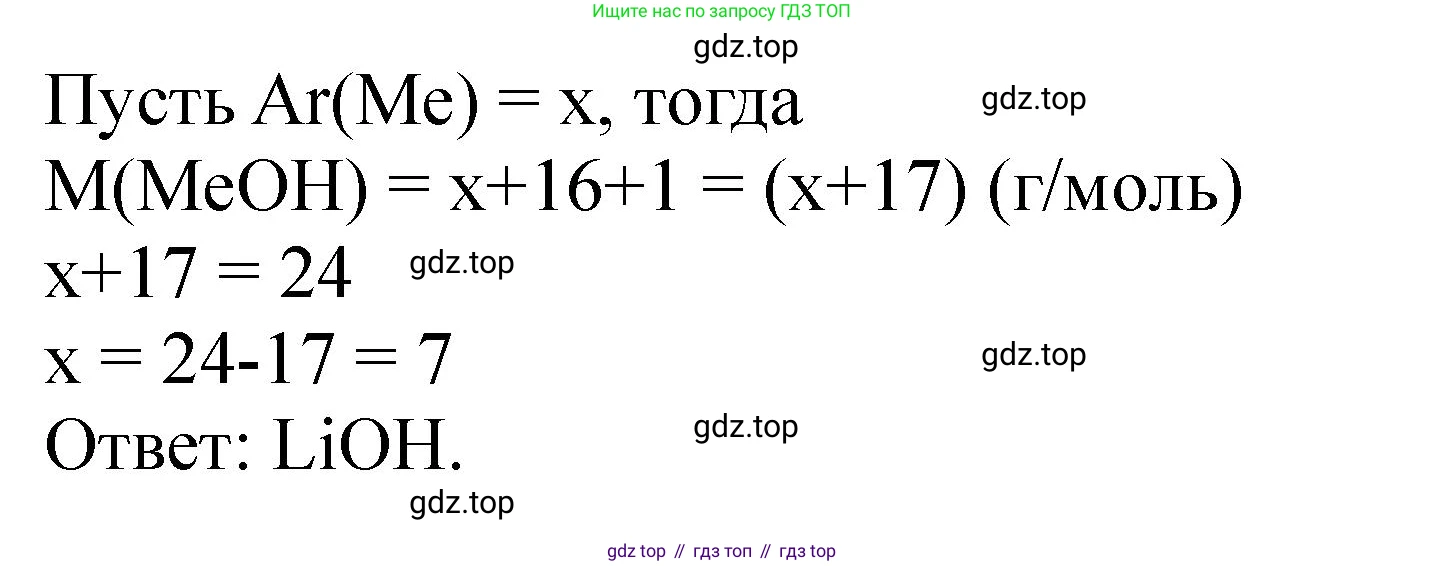
Решение 2. №8 (с. 313)
Дано:
$V(\text{р-ра NaOH}) = 500 \text{ мл}$
$C(\text{NaOH}) = 2 \cdot 10^{-3} \text{ моль/л}$
$m(\text{неизвестной щёлочи}) = 1,2 \cdot 10^{-2} \text{ г}$
$\text{pH}_{\text{конечн}} = 11,48$
Смешение происходит без изменения объёма.
Перевод в единицы, удобные для расчетов:
$V(\text{р-ра}) = 500 \text{ мл} = 0,5 \text{ л}$
$m(\text{неизвестной щёлочи}) = 1,2 \cdot 10^{-2} \text{ г} = 0,012 \text{ г}$
Найти:
Формулу неизвестной щёлочи.
Решение:
1. Для установления формулы щёлочи необходимо найти её молярную массу. Для этого сначала определим количество вещества (моль) добавленной щёлочи.
2. Найдём общую концентрацию гидроксид-ионов ($OH^−$) в конечном растворе, используя значение pH. Водородный показатель (pH) и гидроксильный показатель (pOH) связаны соотношением:
$\text{pOH} = 14 - \text{pH} = 14 - 11,48 = 2,52$
Концентрация гидроксид-ионов равна:
$[OH^-]_{\text{общ}} = 10^{-\text{pOH}} = 10^{-2,52} \approx 3,02 \cdot 10^{-3} \text{ моль/л}$
3. Рассчитаем общее количество вещества гидроксид-ионов в конечном растворе объёмом 0,5 л:
$n(OH^-)_{\text{общ}} = [OH^-]_{\text{общ}} \cdot V = 10^{-2,52} \text{ моль/л} \cdot 0,5 \text{ л} \approx 1,51 \cdot 10^{-3} \text{ моль}$
4. Определим количество вещества гидроксид-ионов, которое было в исходном растворе NaOH. Гидроксид натрия - сильная щёлочь, диссоциирует полностью:
$n(OH^-)_{\text{из NaOH}} = C(\text{NaOH}) \cdot V = 2 \cdot 10^{-3} \text{ моль/л} \cdot 0,5 \text{ л} = 1 \cdot 10^{-3} \text{ моль}$
5. Разница между общим количеством $OH^−$ и количеством $OH^−$ из NaOH даёт нам количество $OH^−$, добавленное с неизвестной щёлочью:
$n(OH^-)_{\text{из неизв. щёлочи}} = n(OH^-)_{\text{общ}} - n(OH^-)_{\text{из NaOH}}$
$n(OH^-)_{\text{из неизв. щёлочи}} = (1,51 \cdot 10^{-3}) - (1 \cdot 10^{-3}) = 0,51 \cdot 10^{-3} \text{ моль}$
Для большей точности используем не округленное значение $10^{-2,52}$:$n(OH^-)_{\text{общ}} = 10^{-2,52} \cdot 0,5 \approx 0,001509975 \text{ моль}$$n(OH^-)_{\text{из неизв. щёлочи}} = 0,001509975 - 0,001 = 0,000509975 \text{ моль}$
6. Теперь можно найти молярную массу неизвестной щёлочи. Щёлочи - это гидроксиды щелочных (I группа) или щёлочноземельных (II группа, кроме Be и Mg) металлов. Проверим обе гипотезы.
Гипотеза 1: Щёлочь - гидроксид щелочного металла, формула MOH.
При диссоциации 1 моль MOH даёт 1 моль $OH^−$. Следовательно:
$n(\text{MOH}) = n(OH^-)_{\text{из неизв. щёлочи}} \approx 0,00051 \text{ моль}$
Молярная масса щёлочи:
$M(\text{MOH}) = \frac{m(\text{щёлочи})}{n(\text{MOH})} = \frac{0,012 \text{ г}}{0,000509975 \text{ моль}} \approx 23,53 \text{ г/моль}$
Молярная масса металла М:
$M(\text{M}) = M(\text{MOH}) - M(\text{OH}) = 23,53 - (16 + 1) = 6,53 \text{ г/моль}$
Это значение очень близко к молярной массе лития ($Li$, $M=6,94$ г/моль). Расхождение, вероятно, связано с округлением данных в условии задачи.
Гипотеза 2: Щёлочь - гидроксид щёлочноземельного металла, формула M(OH)₂.
При диссоциации 1 моль M(OH)₂ даёт 2 моль $OH^−$. Следовательно:
$n(\text{M(OH)}_2) = \frac{n(OH^-)_{\text{из неизв. щёлочи}}}{2} = \frac{0,000509975}{2} \approx 0,000255 \text{ моль}$
Молярная масса щёлочи:
$M(\text{M(OH)}_2) = \frac{m(\text{щёлочи})}{n(\text{M(OH)}_2)} = \frac{0,012 \text{ г}}{0,000255 \text{ моль}} \approx 47,06 \text{ г/моль}$
Молярная масса металла М:
$M(\text{M}) = M(\text{M(OH)}_2) - 2 \cdot M(\text{OH}) = 47,06 - 2 \cdot 17 = 13,06 \text{ г/моль}$
Металла с такой молярной массой в II группе нет.
7. Вывод: наиболее вероятный кандидат - гидроксид лития. Проверим, подставив точную молярную массу LiOH ($M \approx 23,95$ г/моль):
$n(\text{LiOH}) = \frac{0,012 \text{ г}}{23,95 \text{ г/моль}} \approx 0,000501 \text{ моль}$
$n(OH^-)_{\text{общ}} = n(OH^-)_{\text{из NaOH}} + n(OH^-)_{\text{из LiOH}} = 0,001 + 0,000501 = 0,001501 \text{ моль}$
$[OH^-]_{\text{общ}} = \frac{0,001501 \text{ моль}}{0,5 \text{ л}} = 0,003002 \text{ моль/л}$
$\text{pOH} = -\log_{10}(0,003002) \approx 2,522$
$\text{pH} = 14 - 2,522 = 11,478$
Полученное значение pH (11,478) практически совпадает с данным в условии (11,48). Следовательно, неизвестная щёлочь - это гидроксид лития.
Ответ: LiOH
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 8 расположенного на странице 313 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 313), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















