Номер 6, страница 420 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 9. Химия на службе обществу. Параграф 82. Химия в сельском хозяйстве - номер 6, страница 420.
№6 (с. 420)
Условие. №6 (с. 420)
скриншот условия

6. Юному агроному дано задание подкормить яблоню аммиачной селитрой, приготовив раствор из расчёта 1 г соли на 1 л воды. Однако аммиачной селитры у него не оказалось, и он решил заменить её на калийную. Какую массу калийной селитры надо растворить в 1 л воды, чтобы получить раствор с концентрацией азота, которая требовалась?
Решение. №6 (с. 420)
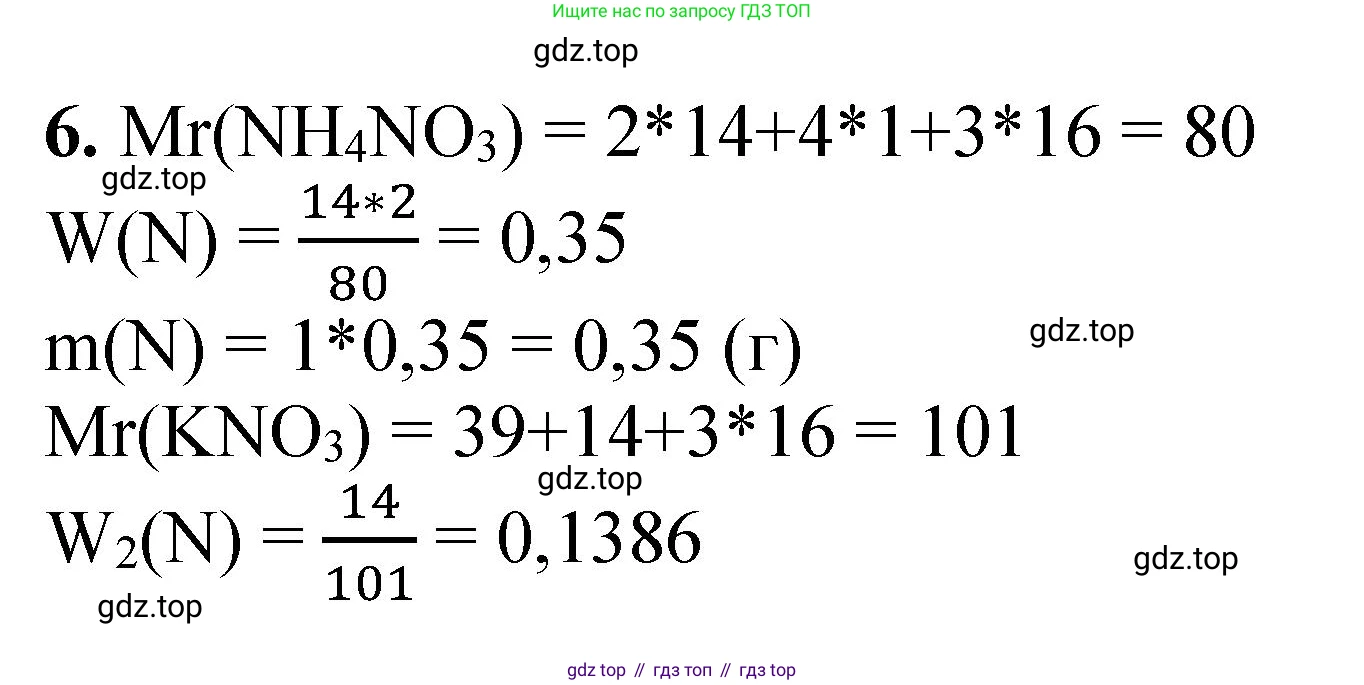

Решение 2. №6 (с. 420)
Дано:
$m(\text{NH}_4\text{NO}_3) = 1 \text{ г}$ (масса аммиачной селитры)
$V(\text{H}_2\text{O}) = 1 \text{ л}$ (объем воды)
Найти:
$m(\text{KNO}_3)$ — ?
Решение:
Основное условие задачи — концентрация азота в новом растворе должна быть такой же, как и в исходном. Поскольку объем воды одинаков (1 л), это означает, что масса элементарного азота (N) в обоих растворах должна быть одинаковой.
1. Найдем массу азота, которая содержалась в 1 г аммиачной селитры ($NH_4NO_3$).
Сначала вычислим молярную массу аммиачной селитры, используя относительные атомные массы элементов: $Ar(\text{N}) = 14$, $Ar(\text{H}) = 1$, $Ar(\text{O}) = 16$.
$M(\text{NH}_4\text{NO}_3) = Ar(\text{N}) \cdot 2 + Ar(\text{H}) \cdot 4 + Ar(\text{O}) \cdot 3 = 14 \cdot 2 + 1 \cdot 4 + 16 \cdot 3 = 28 + 4 + 48 = 80 \text{ г/моль}$.
Теперь найдем массовую долю азота в аммиачной селитре. В одной формульной единице $NH_4NO_3$ содержатся два атома азота.
$\omega(\text{N} \text{ в } \text{NH}_4\text{NO}_3) = \frac{2 \cdot Ar(\text{N})}{M(\text{NH}_4\text{NO}_3)} = \frac{2 \cdot 14}{80} = \frac{28}{80} = 0.35$
Масса азота в 1 г аммиачной селитры равна:
$m_1(\text{N}) = m(\text{NH}_4\text{NO}_3) \cdot \omega(\text{N} \text{ в } \text{NH}_4\text{NO}_3) = 1 \text{ г} \cdot 0.35 = 0.35 \text{ г}$.
2. Найдем, какую массу калийной селитры ($KNO_3$) нужно взять, чтобы в ней содержалось 0.35 г азота.
Сначала вычислим молярную массу калийной селитры, используя относительные атомные массы элементов: $Ar(\text{K}) = 39$, $Ar(\text{N}) = 14$, $Ar(\text{O}) = 16$.
$M(\text{KNO}_3) = Ar(\text{K}) + Ar(\text{N}) + Ar(\text{O}) \cdot 3 = 39 + 14 + 16 \cdot 3 = 53 + 48 = 101 \text{ г/моль}$.
Теперь найдем массовую долю азота в калийной селитре. В одной формульной единице $KNO_3$ содержится один атом азота.
$\omega(\text{N} \text{ в } \text{KNO}_3) = \frac{Ar(\text{N})}{M(\text{KNO}_3)} = \frac{14}{101}$
Масса азота в искомой массе калийной селитры $m(\text{KNO}_3)$ должна быть равна $m_1(\text{N}) = 0.35 \text{ г}$.
$m_1(\text{N}) = m(\text{KNO}_3) \cdot \omega(\text{N} \text{ в } \text{KNO}_3)$
Отсюда выразим искомую массу калийной селитры:
$m(\text{KNO}_3) = \frac{m_1(\text{N})}{\omega(\text{N} \text{ в } \text{KNO}_3)} = \frac{0.35}{\frac{14}{101}} = \frac{0.35 \cdot 101}{14} \approx 2.525 \text{ г}$.
Ответ: чтобы получить раствор с требуемой концентрацией азота, надо растворить в 1 л воды примерно 2.53 г калийной селитры.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 6 расположенного на странице 420 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 420), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















