Номер 4, страница 111 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2025
Уровень обучения: базовый
Цвет обложки: белый, красный
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 3. Неорганическая химия. Тестовые задания к главе 3 - номер 4, страница 111.
№4 (с. 111)
Условие. №4 (с. 111)
скриншот условия

4. Определите вещества X и Y в схеме превращений:
$Fe_2O_3 \xrightarrow{X} Fe \xrightarrow{Y} FeSO_4$.
1) X — $H_2$, Y — $SO_3$
2) X — C, Y — $CuSO_4$
3) X — Al, Y — $H_2SO_4$ (конц.)
4) X — $CO_2$, Y — $H_2SO_4$ (разб.)
Решение. №4 (с. 111)
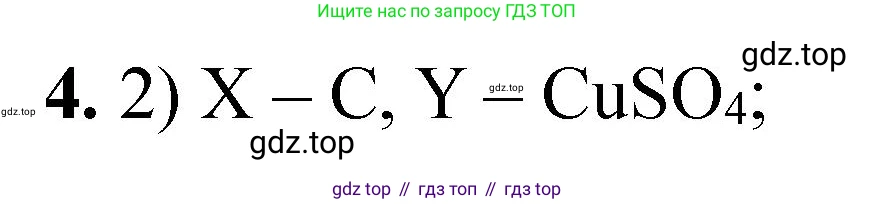
Решение 2. №4 (с. 111)
Решение
В данной задаче необходимо определить вещества X и Y, которые участвуют в двух последовательных химических превращениях: $Fe_2O_3 \xrightarrow{X} Fe \xrightarrow{Y} FeSO_4$.
Этап 1: $Fe_2O_3 \xrightarrow{X} Fe$
На этом этапе оксид железа(III) превращается в металлическое железо. Это реакция восстановления. В качестве восстановителя (вещество X) могут выступать водород ($H_2$), угарный газ ($CO$), углерод (кокс, $C$), а также более активные металлы, например, алюминий ($Al$).
Этап 2: $Fe \xrightarrow{Y} FeSO_4$
На этом этапе из металлического железа получают сульфат железа(II). Это означает, что железо должно прореагировать с веществом Y, содержащим сульфат-ион ($SO_4^{2-}$), и при этом железо должно окислиться до степени окисления +2.
Теперь проанализируем каждый из предложенных вариантов ответа.
1) X — H₂, Y — SO₃
Первая реакция: $Fe_2O_3 + 3H_2 \xrightarrow{t^{\circ}} 2Fe + 3H_2O$. Восстановление водородом возможно. Вторая реакция: $Fe + SO_3 \rightarrow$ ? Оксид серы(VI) является очень сильным окислителем. Он будет окислять железо до степени окисления +3, а не +2. Продуктами будут сульфат железа(III) и диоксид серы: $2Fe + 6SO_3 \rightarrow Fe_2(SO_4)_3 + 3SO_2$. Таким образом, получить $FeSO_4$ не удастся. Вариант неверный.
2) X — C, Y — CuSO₄
Первая реакция: $2Fe_2O_3 + 3C \xrightarrow{t^{\circ}} 4Fe + 3CO_2$. Восстановление железа углем (карботермия) — основной промышленный способ его получения. Реакция возможна. Вторая реакция: $Fe + CuSO_4 \rightarrow FeSO_4 + Cu$. Это реакция замещения, в которой более активное железо вытесняет менее активную медь из раствора её соли. В результате образуется сульфат железа(II). Оба превращения возможны. Вариант верный.
3) X — Al, Y — H₂SO₄ (конц.)
Первая реакция: $Fe_2O_3 + 2Al \xrightarrow{t^{\circ}} 2Fe + Al_2O_3$. Восстановление железа алюминием (алюмотермия) возможно. Вторая реакция: $Fe + H_2SO_4(\text{конц.}) \rightarrow$ ? Концентрированная серная кислота — сильный окислитель. При реакции с железом (особенно при нагревании) она окисляет его до степени окисления +3, образуя сульфат железа(III): $2Fe + 6H_2SO_4(\text{конц.}) \xrightarrow{t^{\circ}} Fe_2(SO_4)_3 + 3SO_2\uparrow + 6H_2O$. Получить $FeSO_4$ таким способом нельзя. Вариант неверный.
4) X — CO₂, Y — H₂SO₄ (разб.)
Первая реакция: $Fe_2O_3 \xrightarrow{CO_2} Fe$. Эта реакция невозможна. Углекислый газ ($CO_2$) не является восстановителем для оксида железа; наоборот, он может окислять железо. Поскольку первый этап не осуществим, весь вариант является неверным, несмотря на то, что вторая реакция ($Fe + H_2SO_4(\text{разб.}) \rightarrow FeSO_4 + H_2\uparrow$) протекает с образованием нужного продукта.
Следовательно, единственная пара реагентов, позволяющая осуществить данную цепь превращений, указана в варианте 2.
Ответ: 2
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 111 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 111), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), базовый уровень обучения учебного пособия издательства Просвещение.

















