Номер 2, страница 77 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 1. Атомы химических элементов. Параграф 12. Ковалентная полярная химическая связь - номер 2, страница 77.
№2 (с. 77)
Условие. №2 (с. 77)

Решение. №2 (с. 77)
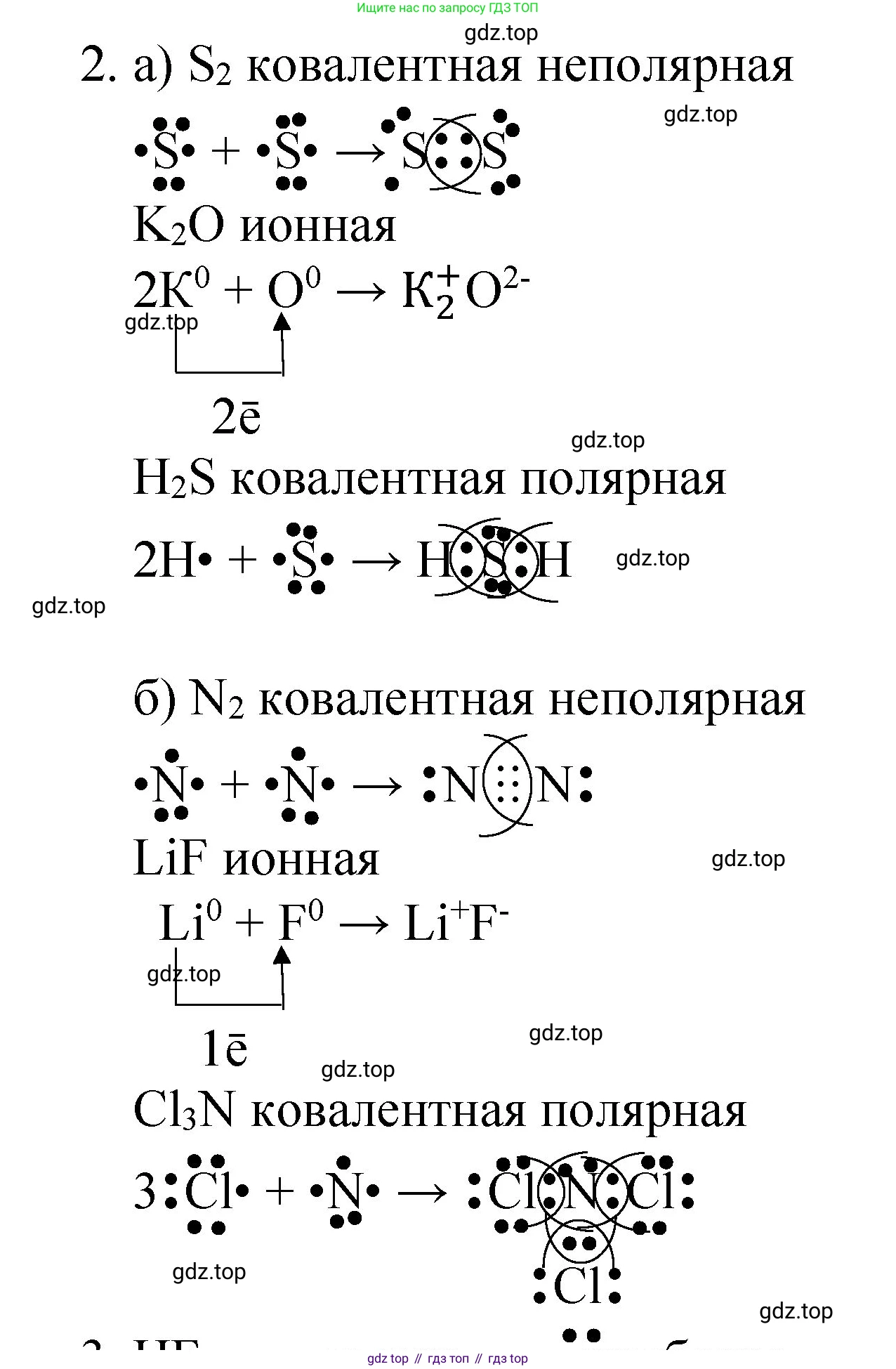
Решение 2. №2 (с. 77)
а) Вещество $S_2$ (дисера)
Тип связи: ковалентная неполярная.
Связь образована атомами одного и того же химического элемента-неметалла (серы $S$). Электроотрицательность атомов одинакова, поэтому электронная плотность общих электронных пар не смещается ни к одному из атомов.
Схема образования связи:
Атом серы ($S$) находится в 16-й группе (VIА подгруппе) периодической системы, его электронная конфигурация внешнего слоя $3s^23p^4$. На внешнем уровне находится 6 валентных электронов. Для достижения стабильной восьмиэлектронной оболочки (октета) каждому атому серы необходимо принять 2 электрона. Два атома серы объединяются, образуя две общие электронные пары (двойную связь).
Схема с использованием электронных точек (формула Льюиса):
$:\ddot{S}\cdot + \cdot\ddot{S}: \rightarrow :\ddot{S}=\ddot{S}:$
Вещество $K_2O$ (оксид калия)
Тип связи: ионная.
Связь образована атомами типичного металла (калий $K$) и типичного неметалла (кислород $O$). Электроотрицательность калия (0.82 по Полингу) значительно ниже электроотрицательности кислорода (3.44 по Полингу). Из-за большой разницы в электроотрицательности ($\Delta\chi \approx 2.62$) валентные электроны от атомов калия практически полностью переходят к атому кислорода, образуя ионы.
Схема образования связи:
Атом калия ($K$), как элемент 1-й группы (IА), имеет 1 валентный электрон, который он легко отдает, превращаясь в катион $K^+$. Атом кислорода ($O$), как элемент 16-й группы (VIА), имеет 6 валентных электронов и для завершения внешнего уровня до октета принимает 2 электрона, превращаясь в анион $O^{2-}$. Таким образом, два атома калия отдают по одному электрону одному атому кислорода.
$K^0 - 1e^- \rightarrow K^+$
$O^0 + 2e^- \rightarrow O^{2-}$
Суммарная схема: $2K\cdot + \cdot\ddot{O}\cdot \rightarrow 2K^+[:\ddot{O}:]^{2-}$
Вещество $H_2S$ (сероводород)
Тип связи: ковалентная полярная.
Связь образована атомами разных неметаллов — водорода ($H$) и серы ($S$). Их электроотрицательности различаются (H ≈ 2.20, S ≈ 2.58), поэтому общие электронные пары смещены в сторону более электроотрицательного атома серы, создавая на нем частичный отрицательный заряд ($\delta-$), а на атомах водорода — частичный положительный заряд ($\delta+$).
Схема образования связи:
Атому серы (6 валентных электронов) для завершения внешнего уровня не хватает 2 электронов. Атому водорода (1 валентный электрон) для завершения своего уровня до дублета не хватает 1 электрона. Атом серы образует две одинарные ковалентные связи, предоставляя по одному электрону для образования общей пары с каждым из двух атомов водорода.
Схема Льюиса: $2H\cdot + \cdot\ddot{S}\cdot \rightarrow H:\ddot{S}:H$
Ответ: $S_2$ – ковалентная неполярная связь; $K_2O$ – ионная связь; $H_2S$ – ковалентная полярная связь.
б) Вещество $N_2$ (азот)
Тип связи: ковалентная неполярная.
Связь в молекуле азота образована двумя одинаковыми атомами неметалла ($N$). Разница электроотрицательностей равна нулю.
Схема образования связи:
Атом азота ($N$) находится в 15-й группе (VА), имеет 5 валентных электронов ($2s^22p^3$). Для достижения октета каждому атому не хватает 3 электронов. Два атома азота образуют между собой три общие электронные пары, формируя тройную связь. У каждого атома азота также остается одна неподеленная электронная пара.
Схема Льюиса: $:\dot{N}\cdot + \cdot\dot{N}: \rightarrow :N\equiv N:$
Вещество $LiF$ (фторид лития)
Тип связи: ионная.
Связь образована атомами типичного металла лития ($Li$) и самого электроотрицательного неметалла фтора ($F$). Разница в их электроотрицательностях максимальна ($\Delta\chi \approx 3.0$), что приводит к полному переходу валентного электрона от лития к фтору.
Схема образования связи:
Атом лития ($Li$), элемент 1-й группы (IА), отдает свой единственный валентный электрон и превращается в катион $Li^+$. Атом фтора ($F$), элемент 17-й группы (VIIА), имеет 7 валентных электронов и принимает один электрон для завершения октета, превращаясь в анион $F^-$.
$Li^0 - 1e^- \rightarrow Li^+$
$F^0 + 1e^- \rightarrow F^-$
Суммарная схема: $Li\cdot + :\ddot{F}\cdot \rightarrow Li^+[:\ddot{F}:]^-$
Вещество $Cl_3N$ (трихлорид азота, или хлорид азота(III))
Тип связи: ковалентная полярная.
Связь образована атомами разных неметаллов — азота ($N$) и хлора ($Cl$). Их электроотрицательности близки, но не равны (N ≈ 3.04, Cl ≈ 3.16). Общие электронные пары незначительно смещены к более электроотрицательному атому хлора.
Схема образования связи:
Атому азота (5 валентных электронов) необходимо 3 электрона для завершения октета. Каждому атому хлора (7 валентных электронов) не хватает 1 электрона. Атом азота образует три одинарные ковалентные связи с тремя атомами хлора. У центрального атома азота остается одна неподеленная электронная пара.
Схема Льюиса: $\cdot\ddot{N}\cdot + 3(\cdot\ddot{Cl}:) \rightarrow :\ddot{Cl}-\underset{\Large :\ddot{Cl}:}{\underset{|}{\overset{\Large ..}{\ddot{N}}}}-\ddot{Cl}:$
Ответ: $N_2$ – ковалентная неполярная связь; $LiF$ – ионная связь; $Cl_3N$ – ковалентная полярная связь.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 77 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 77), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















