Номер 3.30, страница 20, часть I - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: I
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть I. Вычисления по химическим формулам. 3. Массовая доля химического элемента. Вывод формулы вещества - номер 3.30, страница 20.
№3.30 (с. 20)
Условие. №3.30 (с. 20)
скриншот условия

3.30. Сравните массовые доли кислорода, содержащегося в одинаковых количествах воды и водяного пара.
Решение. №3.30 (с. 20)
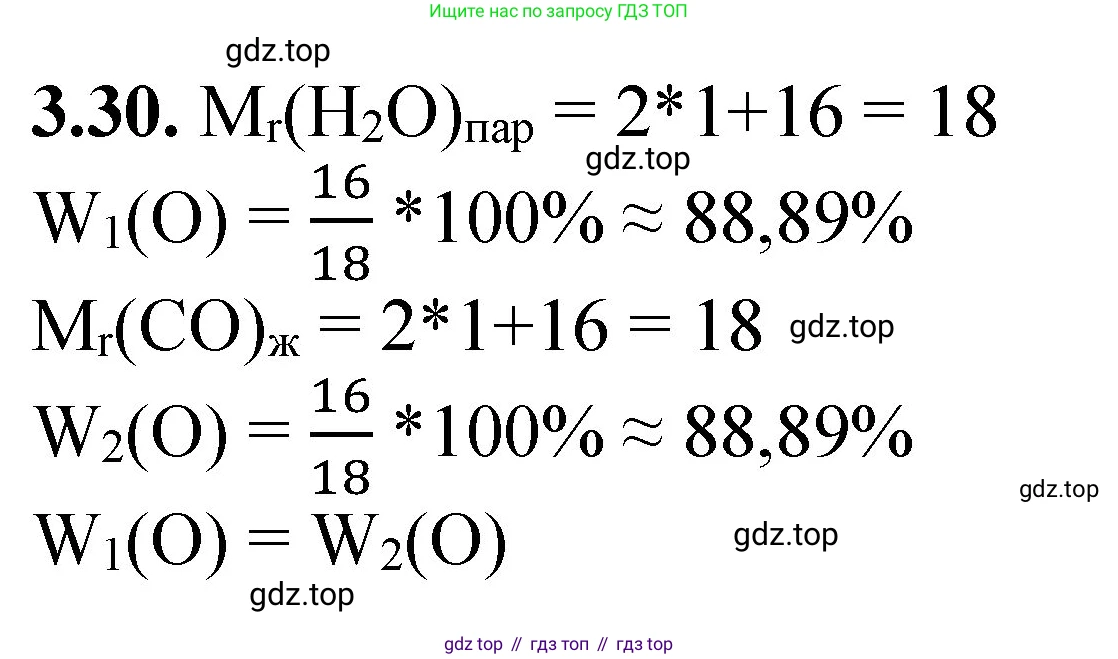
Решение 2. №3.30 (с. 20)
Дано:
Вода (в жидком состоянии) и водяной пар (в газообразном состоянии), взятые в одинаковых количествах вещества (моль).
Найти:
Сравнить массовые доли кислорода ($w(O)$) в воде и водяном паре.
Решение:
Вода и водяной пар являются разными агрегатными состояниями одного и того же химического вещества. Химическая формула этого вещества — $H_2O$.
Массовая доля элемента в веществе — это характеристика состава вещества, которая не зависит от его агрегатного состояния (жидкое, твердое или газообразное) или от количества взятого вещества. Она определяется только химической формулой.
Массовую долю элемента ($Э$) в веществе рассчитывают по формуле:
$w(Э) = \frac{n \cdot A_r(Э)}{M_r(\text{вещества})} \cdot 100\%$
где $n$ — количество атомов данного элемента в одной формульной единице вещества, $A_r(Э)$ — относительная атомная масса элемента, а $M_r(\text{вещества})$ — относительная молекулярная (или формульная) масса вещества.
Поскольку химическая формула для воды и водяного пара одинакова ($H_2O$), массовая доля кислорода в них будет абсолютно одинаковой. Проведем расчет, чтобы это показать.
1. Вычислим относительную молекулярную массу воды ($H_2O$). Для этого используем относительные атомные массы водорода и кислорода из Периодической системы химических элементов Д. И. Менделеева, округленные до целых чисел:
$A_r(H) = 1$
$A_r(O) = 16$
$M_r(H_2O) = 2 \cdot A_r(H) + 1 \cdot A_r(O) = 2 \cdot 1 + 16 = 18$.
2. Рассчитаем массовую долю кислорода ($O$) в воде. В одной молекуле $H_2O$ содержится один атом кислорода ($n=1$).
$w(O) = \frac{1 \cdot A_r(O)}{M_r(H_2O)} = \frac{1 \cdot 16}{18} = \frac{16}{18} = \frac{8}{9} \approx 0,889$.
В процентах это составляет: $0,889 \cdot 100\% = 88,9\%$.
Этот расчет справедлив как для жидкой воды, так и для водяного пара, поскольку он основан исключительно на химической формуле $H_2O$.
Ответ: Массовые доли кислорода в воде и водяном паре равны, так как это одно и то же вещество ($H_2O$) с одинаковым элементным составом, находящееся в разных агрегатных состояниях. Массовая доля кислорода в обоих случаях составляет приблизительно $88,9\%$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 3.30 расположенного на странице 20 для I-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3.30 (с. 20), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), I-й части учебного пособия издательства Просвещение.
















