Номер 3.23, страница 19, часть I - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: I
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть I. Вычисления по химическим формулам. 3. Массовая доля химического элемента. Вывод формулы вещества - номер 3.23, страница 19.
№3.23 (с. 19)
Условие. №3.23 (с. 19)
скриншот условия

3.23. Рассчитайте массовые доли элементов в доломите $MgCa(CO_3)_2$.
Решение. №3.23 (с. 19)
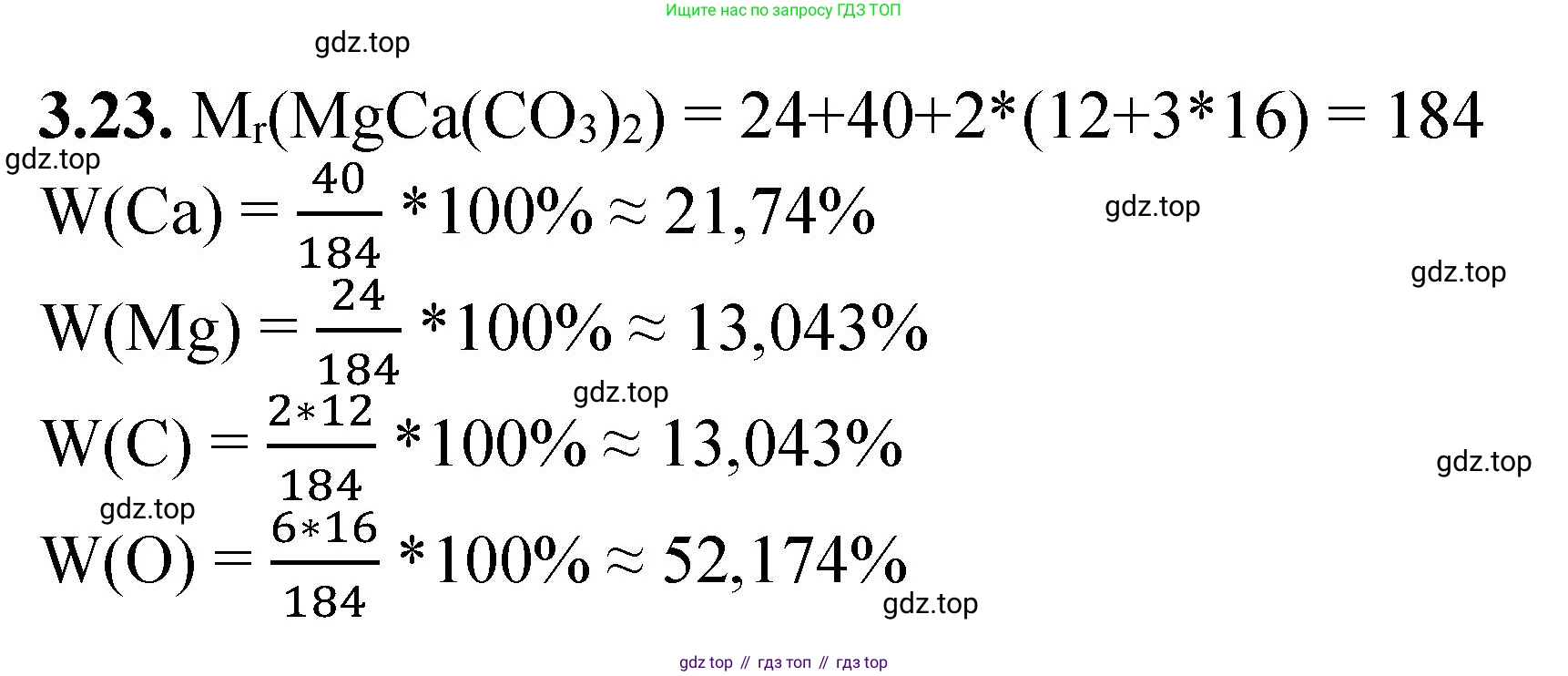
Решение 2. №3.23 (с. 19)
Дано:
Соединение: доломит, $MgCa(CO_3)_2$.
Относительные атомные массы элементов (округленные до целых):
$A_r(Mg) = 24$
$A_r(Ca) = 40$
$A_r(C) = 12$
$A_r(O) = 16$
Найти:
Массовые доли элементов в доломите: $ \omega(Mg), \omega(Ca), \omega(C), \omega(O) $.
Решение:
1. Рассчитаем относительную молекулярную массу доломита $M_r(MgCa(CO_3)_2)$. Формула $MgCa(CO_3)_2$ показывает, что в одной формульной единице вещества содержится 1 атом магния (Mg), 1 атом кальция (Ca), 2 атома углерода (C) и $2 \times 3 = 6$ атомов кислорода (O).
Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, входящих в состав формульной единицы:
$M_r(MgCa(CO_3)_2) = A_r(Mg) \cdot 1 + A_r(Ca) \cdot 1 + A_r(C) \cdot 2 + A_r(O) \cdot 6$
$M_r(MgCa(CO_3)_2) = 24 \cdot 1 + 40 \cdot 1 + 12 \cdot 2 + 16 \cdot 6 = 24 + 40 + 24 + 96 = 184$
Молярная масса доломита $M(MgCa(CO_3)_2)$ численно равна относительной молекулярной массе и составляет 184 г/моль.
2. Рассчитаем массовые доли ($ \omega $) каждого элемента в соединении по общей формуле:
$ \omega(элемента) = \frac{n \cdot A_r(элемента)}{M_r(соединения)} \cdot 100\% $
где $n$ — число атомов элемента в формуле.
Массовая доля магния (Mg):
$ \omega(Mg) = \frac{1 \cdot 24}{184} \cdot 100\% \approx 0.1304 \cdot 100\% = 13.04\% $
Массовая доля кальция (Ca):
$ \omega(Ca) = \frac{1 \cdot 40}{184} \cdot 100\% \approx 0.2174 \cdot 100\% = 21.74\% $
Массовая доля углерода (C):
$ \omega(C) = \frac{2 \cdot 12}{184} \cdot 100\% = \frac{24}{184} \cdot 100\% \approx 0.1304 \cdot 100\% = 13.04\% $
Массовая доля кислорода (O):
$ \omega(O) = \frac{6 \cdot 16}{184} \cdot 100\% = \frac{96}{184} \cdot 100\% \approx 0.5217 \cdot 100\% = 52.17\% $
3. Проведем проверку: сумма массовых долей всех элементов должна быть равна 100%.
$ 13.04\% + 21.74\% + 13.04\% + 52.17\% = 99.99\% $
Сумма близка к 100%, расхождение в 0.01% возникло из-за округления промежуточных результатов.
Ответ: Массовые доли элементов в доломите составляют: $ \omega(Mg) \approx 13.04\% $; $ \omega(Ca) \approx 21.74\% $; $ \omega(C) \approx 13.04\% $; $ \omega(O) \approx 52.17\% $.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 3.23 расположенного на странице 19 для I-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3.23 (с. 19), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), I-й части учебного пособия издательства Просвещение.
















