Номер 2-12, страница 24 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 2. Химические реакции. 2.1. Составление уравнений химических реакций - номер 2-12, страница 24.
№2-12 (с. 24)
Условие. №2-12 (с. 24)
скриншот условия
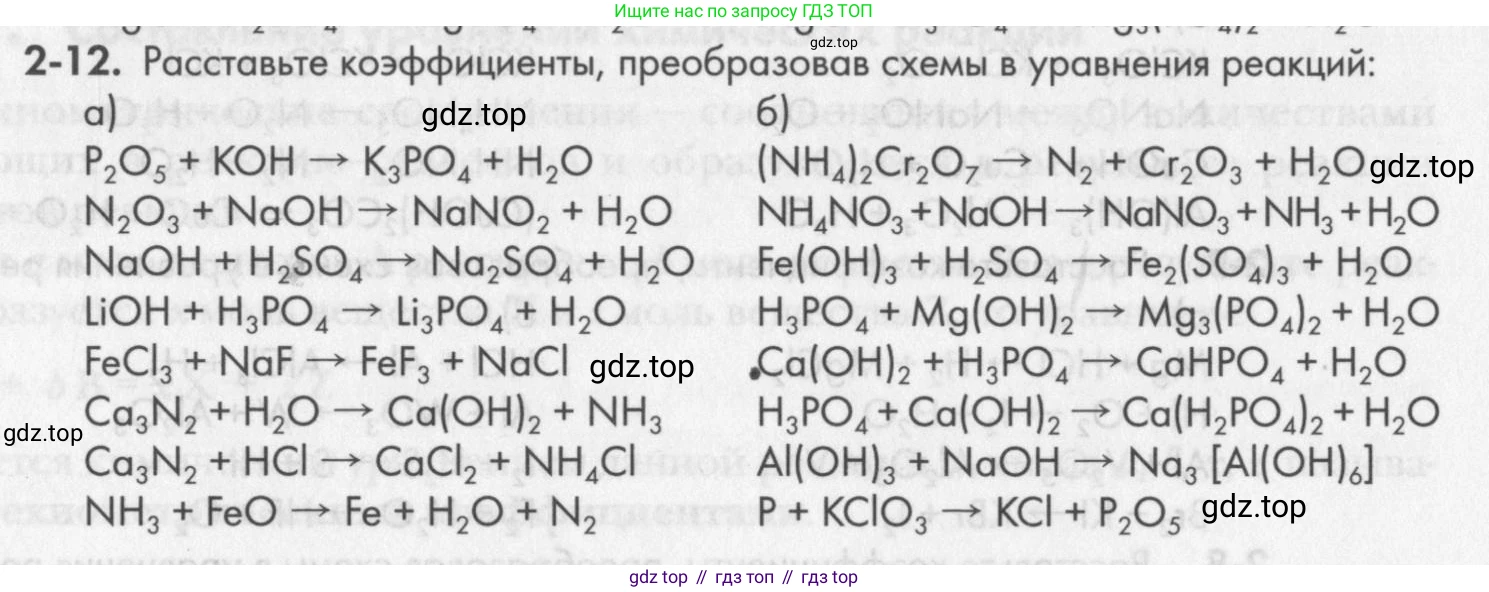
2-12. Расставьте коэффициенты, преобразовав схемы в уравнения реакций:
а) $P_2O_5 + KOH \rightarrow K_3PO_4 + H_2O$
$N_2O_3 + NaOH \rightarrow NaNO_2 + H_2O$
$NaOH + H_2SO_4 \rightarrow Na_2SO_4 + H_2O$
$LiOH + H_3PO_4 \rightarrow Li_3PO_4 + H_2O$
$FeCl_3 + NaF \rightarrow FeF_3 + NaCl$
$Ca_3N_2 + H_2O \rightarrow Ca(OH)_2 + NH_3$
$Ca_3N_2 + HCl \rightarrow CaCl_2 + NH_4Cl$
$NH_3 + FeO \rightarrow Fe + H_2O + N_2$
б) $(NH_4)_2Cr_2O_7 \rightarrow N_2 + Cr_2O_3 + H_2O$
$NH_4NO_3 + NaOH \rightarrow NaNO_3 + NH_3 + H_2O$
$Fe(OH)_3 + H_2SO_4 \rightarrow Fe_2(SO_4)_3 + H_2O$
$H_3PO_4 + Mg(OH)_2 \rightarrow Mg_3(PO_4)_2 + H_2O$
$Ca(OH)_2 + H_3PO_4 \rightarrow CaHPO_4 + H_2O$
$H_3PO_4 + Ca(OH)_2 \rightarrow Ca(H_2PO_4)_2 + H_2O$
$Al(OH)_3 + NaOH \rightarrow Na_3[Al(OH)_6]$
$P + KClO_3 \rightarrow KCl + P_2O_5$
Решение. №2-12 (с. 24)

Решение 2. №2-12 (с. 24)
a)
1. $P_2O_5 + KOH \rightarrow K_3PO_4 + H_2O$
Для уравнивания этой реакции используем метод подбора.
1. Начнем с фосфора (P). В левой части 2 атома P (в $P_2O_5$), в правой — 1 (в $K_3PO_4$). Ставим коэффициент 2 перед $K_3PO_4$:
$P_2O_5 + KOH \rightarrow 2K_3PO_4 + H_2O$
2. Теперь уравняем калий (K). Слева 1 атом, а справа $2 \cdot 3 = 6$ атомов. Ставим коэффициент 6 перед $KOH$:
$P_2O_5 + 6KOH \rightarrow 2K_3PO_4 + H_2O$
3. Уравняем водород (H). Слева 6 атомов H (в $6KOH$), справа 2 атома H (в $H_2O$). Ставим коэффициент 3 перед $H_2O$, чтобы получить $3 \cdot 2 = 6$ атомов H.
$P_2O_5 + 6KOH \rightarrow 2K_3PO_4 + 3H_2O$
4. Проверим кислород (O). Слева: $5 + 6 = 11$ атомов. Справа: $2 \cdot 4 + 3 = 8 + 3 = 11$ атомов. Баланс достигнут.
Ответ: $P_2O_5 + 6KOH \rightarrow 2K_3PO_4 + 3H_2O$
2. $N_2O_3 + NaOH \rightarrow NaNO_2 + H_2O$
1. Уравняем азот (N). Слева 2 атома, справа 1. Ставим коэффициент 2 перед $NaNO_2$:
$N_2O_3 + NaOH \rightarrow 2NaNO_2 + H_2O$
2. Уравняем натрий (Na). Слева 1 атом, справа 2. Ставим коэффициент 2 перед $NaOH$:
$N_2O_3 + 2NaOH \rightarrow 2NaNO_2 + H_2O$
3. Проверим водород (H) и кислород (O).
Слева: H - 2, O - $3 + 2 = 5$.
Справа: H - 2, O - $2 \cdot 2 + 1 = 5$.
Все атомы уравнены.
Ответ: $N_2O_3 + 2NaOH \rightarrow 2NaNO_2 + H_2O$
3. $NaOH + H_2SO_4 \rightarrow Na_2SO_4 + H_2O$
1. Уравняем натрий (Na). Слева 1 атом, справа 2. Ставим коэффициент 2 перед $NaOH$:
$2NaOH + H_2SO_4 \rightarrow Na_2SO_4 + H_2O$
2. Уравняем водород (H). Слева $2 \cdot 1 + 2 = 4$ атома. Справа 2 атома. Ставим коэффициент 2 перед $H_2O$:
$2NaOH + H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O$
3. Проверим кислород (O).
Слева: $2 \cdot 1 + 4 = 6$.
Справа: $4 + 2 \cdot 1 = 6$.
Баланс достигнут.
Ответ: $2NaOH + H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O$
4. $LiOH + H_3PO_4 \rightarrow Li_3PO_4 + H_2O$
1. Уравняем литий (Li). Слева 1 атом, справа 3. Ставим коэффициент 3 перед $LiOH$:
$3LiOH + H_3PO_4 \rightarrow Li_3PO_4 + H_2O$
2. Уравняем водород (H). Слева $3 \cdot 1 + 3 = 6$ атомов. Справа 2 атома. Ставим коэффициент 3 перед $H_2O$:
$3LiOH + H_3PO_4 \rightarrow Li_3PO_4 + 3H_2O$
3. Проверим кислород (O).
Слева: $3 \cdot 1 + 4 = 7$.
Справа: $4 + 3 \cdot 1 = 7$.
Баланс достигнут.
Ответ: $3LiOH + H_3PO_4 \rightarrow Li_3PO_4 + 3H_2O$
5. $FeCl_3 + NaF \rightarrow FeF_3 + NaCl$
1. Уравняем хлор (Cl). Слева 3 атома, справа 1. Ставим коэффициент 3 перед $NaCl$:
$FeCl_3 + NaF \rightarrow FeF_3 + 3NaCl$
2. Уравняем натрий (Na). Слева 1 атом, справа 3. Ставим коэффициент 3 перед $NaF$:
$FeCl_3 + 3NaF \rightarrow FeF_3 + 3NaCl$
3. Проверим железо (Fe) и фтор (F).
Слева: Fe - 1, F - 3.
Справа: Fe - 1, F - 3.
Все атомы уравнены.
Ответ: $FeCl_3 + 3NaF \rightarrow FeF_3 + 3NaCl$
6. $Ca_3N_2 + H_2O \rightarrow Ca(OH)_2 + NH_3$
1. Уравняем кальций (Ca). Слева 3 атома, справа 1. Ставим коэффициент 3 перед $Ca(OH)_2$:
$Ca_3N_2 + H_2O \rightarrow 3Ca(OH)_2 + NH_3$
2. Уравняем азот (N). Слева 2 атома, справа 1. Ставим коэффициент 2 перед $NH_3$:
$Ca_3N_2 + H_2O \rightarrow 3Ca(OH)_2 + 2NH_3$
3. Уравняем водород (H) и кислород (O).
Справа: H - $3 \cdot 2 + 2 \cdot 3 = 12$, O - $3 \cdot 2 = 6$.
Слева нужно 12 атомов H и 6 атомов O. Ставим коэффициент 6 перед $H_2O$:
$Ca_3N_2 + 6H_2O \rightarrow 3Ca(OH)_2 + 2NH_3$
4. Проверка: слева H - $6 \cdot 2 = 12$, O - 6. Баланс достигнут.
Ответ: $Ca_3N_2 + 6H_2O \rightarrow 3Ca(OH)_2 + 2NH_3$
7. $Ca_3N_2 + HCl \rightarrow CaCl_2 + NH_4Cl$
1. Уравняем кальций (Ca). Слева 3 атома, справа 1. Ставим коэффициент 3 перед $CaCl_2$:
$Ca_3N_2 + HCl \rightarrow 3CaCl_2 + NH_4Cl$
2. Уравняем азот (N). Слева 2 атома, справа 1. Ставим коэффициент 2 перед $NH_4Cl$:
$Ca_3N_2 + HCl \rightarrow 3CaCl_2 + 2NH_4Cl$
3. Уравняем водород (H) и хлор (Cl).
Справа: H - $2 \cdot 4 = 8$, Cl - $3 \cdot 2 + 2 \cdot 1 = 8$.
Слева нужно 8 атомов H и 8 атомов Cl. Ставим коэффициент 8 перед $HCl$.
Ответ: $Ca_3N_2 + 8HCl \rightarrow 3CaCl_2 + 2NH_4Cl$
8. $NH_3 + FeO \rightarrow Fe + H_2O + N_2$
Это окислительно-восстановительная реакция. Расставим коэффициенты методом электронного баланса.
1. Определим степени окисления элементов, которые их изменяют:
$N^{-3}H_3 + Fe^{+2}O \rightarrow Fe^0 + H_2O + N_2^0$
2. Составим полуреакции окисления и восстановления:
$2N^{-3} - 6e^- \rightarrow N_2^0$ (окисление)
$Fe^{+2} + 2e^- \rightarrow Fe^0$ (восстановление)
3. Найдем наименьшее общее кратное для числа отданных и принятых электронов (6 и 2), оно равно 6. Умножим вторую полуреакцию на 3:
$2N^{-3} - 6e^- \rightarrow N_2^0$ | 1
$Fe^{+2} + 2e^- \rightarrow Fe^0$ | 3
4. Расставим коэффициенты: 2 перед $NH_3$, 1 перед $N_2$ (не пишется), 3 перед $FeO$ и 3 перед $Fe$:
$2NH_3 + 3FeO \rightarrow 3Fe + H_2O + N_2$
5. Уравняем водород и кислород. Слева 6 атомов H, справа 2. Ставим коэффициент 3 перед $H_2O$. Проверяем кислород: слева 3, справа 3. Баланс достигнут.
Ответ: $2NH_3 + 3FeO \rightarrow 3Fe + 3H_2O + N_2$
б)
1. $(NH_4)_2Cr_2O_7 \rightarrow N_2 + Cr_2O_3 + H_2O$
1. Проверим баланс атомов N и Cr. Слева 2 атома N и 2 атома Cr. Справа 2 атома N и 2 атома Cr. Они сбалансированы.
2. Уравняем водород (H). Слева $2 \cdot 4 = 8$ атомов. Справа 2 атома. Ставим коэффициент 4 перед $H_2O$:
$(NH_4)_2Cr_2O_7 \rightarrow N_2 + Cr_2O_3 + 4H_2O$
3. Проверим кислород (O). Слева 7 атомов. Справа $3 + 4 \cdot 1 = 7$ атомов. Баланс достигнут.
Ответ: $(NH_4)_2Cr_2O_7 \rightarrow N_2 + Cr_2O_3 + 4H_2O$
2. $NH_4NO_3 + NaOH \rightarrow NaNO_3 + NH_3 + H_2O$
Проверим количество атомов с обеих сторон:
Слева: N - 2, H - 5, O - 4, Na - 1.
Справа: Na - 1, N - 2, O - 4, H - 5.
Количество всех атомов слева и справа одинаково. Уравнение уже сбалансировано.
Ответ: $NH_4NO_3 + NaOH \rightarrow NaNO_3 + NH_3 + H_2O$
3. $Fe(OH)_3 + H_2SO_4 \rightarrow Fe_2(SO_4)_3 + H_2O$
1. Уравняем железо (Fe). Слева 1 атом, справа 2. Ставим коэффициент 2 перед $Fe(OH)_3$:
$2Fe(OH)_3 + H_2SO_4 \rightarrow Fe_2(SO_4)_3 + H_2O$
2. Уравняем сульфат-ионы ($SO_4$). Слева 1, справа 3. Ставим коэффициент 3 перед $H_2SO_4$:
$2Fe(OH)_3 + 3H_2SO_4 \rightarrow Fe_2(SO_4)_3 + H_2O$
3. Уравняем водород (H). Слева $2 \cdot 3 + 3 \cdot 2 = 12$ атомов. Справа 2 атома. Ставим коэффициент 6 перед $H_2O$:
$2Fe(OH)_3 + 3H_2SO_4 \rightarrow Fe_2(SO_4)_3 + 6H_2O$
4. Проверим кислород (O) вне сульфат-ионов. Слева в $2Fe(OH)_3$ их $2 \cdot 3 = 6$. Справа в $6H_2O$ их 6. Баланс достигнут.
Ответ: $2Fe(OH)_3 + 3H_2SO_4 \rightarrow Fe_2(SO_4)_3 + 6H_2O$
4. $H_3PO_4 + Mg(OH)_2 \rightarrow Mg_3(PO_4)_2 + H_2O$
1. Уравняем магний (Mg). Слева 1 атом, справа 3. Ставим коэффициент 3 перед $Mg(OH)_2$:
$H_3PO_4 + 3Mg(OH)_2 \rightarrow Mg_3(PO_4)_2 + H_2O$
2. Уравняем фосфат-ионы ($PO_4$). Слева 1, справа 2. Ставим коэффициент 2 перед $H_3PO_4$:
$2H_3PO_4 + 3Mg(OH)_2 \rightarrow Mg_3(PO_4)_2 + H_2O$
3. Уравняем водород (H). Слева $2 \cdot 3 + 3 \cdot 2 = 12$ атомов. Справа 2 атома. Ставим коэффициент 6 перед $H_2O$:
$2H_3PO_4 + 3Mg(OH)_2 \rightarrow Mg_3(PO_4)_2 + 6H_2O$
4. Проверим кислород (O) вне фосфат-ионов. Слева в $3Mg(OH)_2$ их $3 \cdot 2 = 6$. Справа в $6H_2O$ их 6. Баланс достигнут.
Ответ: $2H_3PO_4 + 3Mg(OH)_2 \rightarrow Mg_3(PO_4)_2 + 6H_2O$
5. $Ca(OH)_2 + H_3PO_4 \rightarrow CaHPO_4 + H_2O$
1. Атомы Ca и P уже сбалансированы (по 1 с каждой стороны).
2. Подсчитаем атомы H и O. Слева: H = $2+3=5$, O = $2+4=6$. Справа (в $CaHPO_4$): H=1, O=4.
3. Чтобы сбалансировать атомы, справа не хватает 4 атома H и 2 атома O. Это соответствует 2 молекулам воды ($2H_2O$). Ставим коэффициент 2 перед $H_2O$:
$Ca(OH)_2 + H_3PO_4 \rightarrow CaHPO_4 + 2H_2O$
4. Проверка. Слева: Ca(1), H(5), P(1), O(6). Справа: Ca(1), H(1 + 2*2=5), P(1), O(4+2=6). Баланс достигнут.
Ответ: $Ca(OH)_2 + H_3PO_4 \rightarrow CaHPO_4 + 2H_2O$
6. $H_3PO_4 + Ca(OH)_2 \rightarrow Ca(H_2PO_4)_2 + H_2O$
1. Уравняем фосфор (P). Слева 1 атом, справа 2. Ставим коэффициент 2 перед $H_3PO_4$:
$2H_3PO_4 + Ca(OH)_2 \rightarrow Ca(H_2PO_4)_2 + H_2O$
2. Атом Ca уже сбалансирован.
3. Уравняем водород (H). Слева $2 \cdot 3 + 2 = 8$ атомов. Справа (в $Ca(H_2PO_4)_2$) $2 \cdot 2 = 4$ атома. Не хватает 4 атомов H. Ставим коэффициент 2 перед $H_2O$:
$2H_3PO_4 + Ca(OH)_2 \rightarrow Ca(H_2PO_4)_2 + 2H_2O$
4. Проверим кислород (O). Слева: $2 \cdot 4 + 2 = 10$. Справа: $2 \cdot 4 + 2 \cdot 1 = 10$. Баланс достигнут.
Ответ: $2H_3PO_4 + Ca(OH)_2 \rightarrow Ca(H_2PO_4)_2 + 2H_2O$
7. $Al(OH)_3 + NaOH \rightarrow Na_3[Al(OH)_6]$
1. Уравняем натрий (Na). Слева 1 атом, справа 3. Ставим коэффициент 3 перед $NaOH$:
$Al(OH)_3 + 3NaOH \rightarrow Na_3[Al(OH)_6]$
2. Проверим остальные атомы.
Слева: Al - 1, O - $3+3=6$, H - $3+3=6$.
Справа: Al - 1, O - 6, H - 6.
Баланс достигнут.
Ответ: $Al(OH)_3 + 3NaOH \rightarrow Na_3[Al(OH)_6]$
8. $P + KClO_3 \rightarrow KCl + P_2O_5$
Это окислительно-восстановительная реакция. Расставим коэффициенты методом электронного баланса.
1. Определим степени окисления элементов, которые их изменяют:
$P^0 + K Cl^{+5} O_3 \rightarrow K Cl^{-1} + P_2^{+5} O_5$
2. Составим полуреакции окисления и восстановления:
$2P^0 - 10e^- \rightarrow P_2^{+5}$ (окисление)
$Cl^{+5} + 6e^- \rightarrow Cl^{-1}$ (восстановление)
3. Найдем наименьшее общее кратное для числа электронов (10 и 6), оно равно 30. Умножим первую полуреакцию на 3, а вторую на 5:
$2P^0 - 10e^- \rightarrow P_2^{+5}$ | 3
$Cl^{+5} + 6e^- \rightarrow Cl^{-1}$ | 5
4. Расставим коэффициенты: $3 \cdot 2 = 6$ перед P, 5 перед $KClO_3$, 5 перед $KCl$, 3 перед $P_2O_5$:
$6P + 5KClO_3 \rightarrow 5KCl + 3P_2O_5$
5. Проверим остальные атомы. Калий (K): слева 5, справа 5. Кислород (O): слева $5 \cdot 3 = 15$, справа $3 \cdot 5 = 15$. Баланс достигнут.
Ответ: $6P + 5KClO_3 \rightarrow 5KCl + 3P_2O_5$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2-12 расположенного на странице 24 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2-12 (с. 24), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















