Номер 7-13, страница 84 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.1. Характер связи в химических соединениях - номер 7-13, страница 84.
№7-13 (с. 84)
Условие. №7-13 (с. 84)
скриншот условия

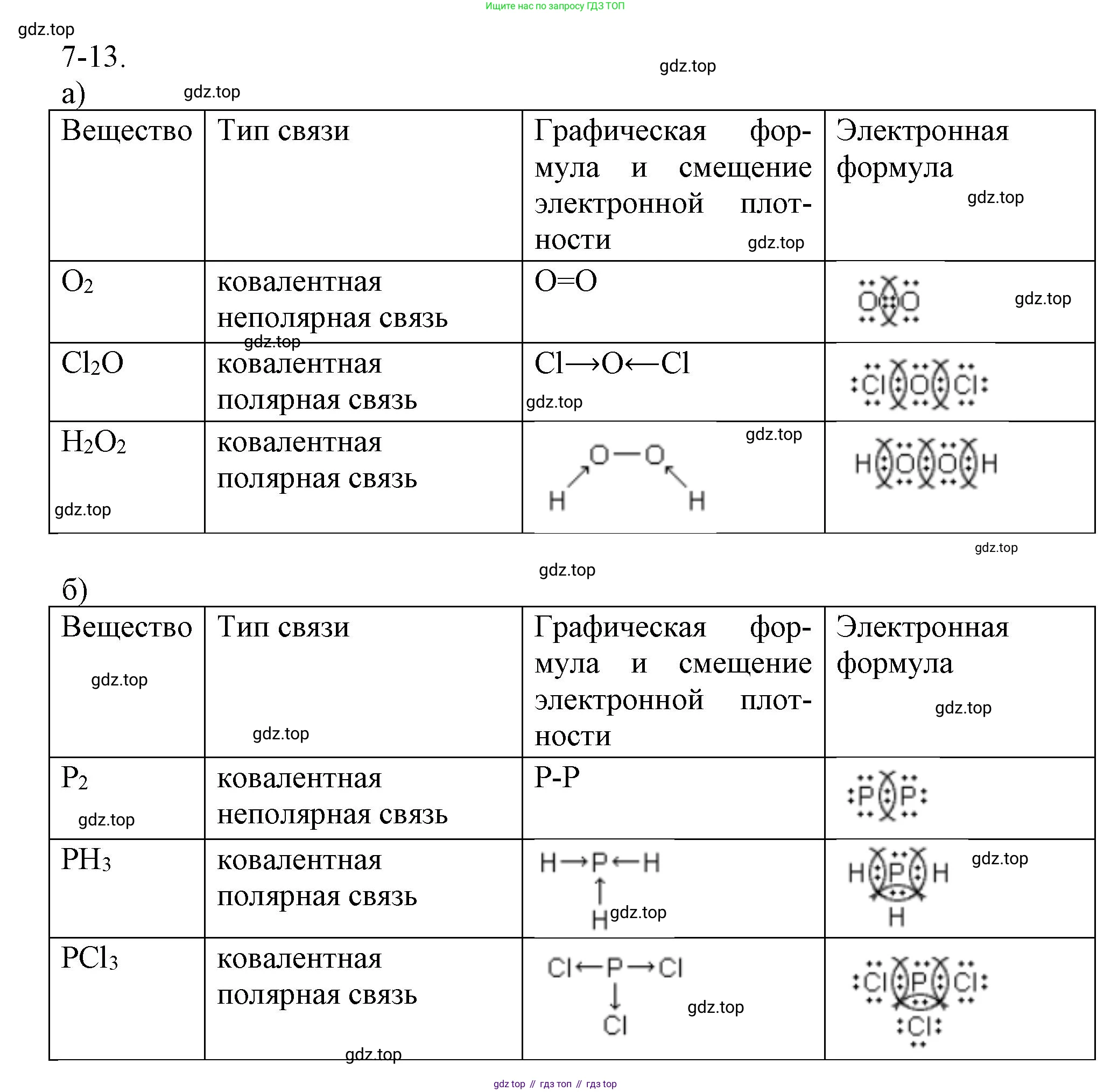
7-13. Составьте электронные и графические формулы веществ:
а) $O_2$, $Cl_2O$, $H_2O_2$;
б) $P_2$, $PH_3$, $PCl_3$.
Укажите направление смещения электронной плотности и назовите тип химической связи.
Решение. №7-13 (с. 84)
Решение 2. №7-13 (с. 84)
Решение:
Вещество: $O_2$ (кислород)
Электронная формула (формула Льюиса):
Атом кислорода (O) находится в 16-й группе периодической системы и имеет 6 валентных электронов. Для достижения стабильного восьмиэлектронного внешнего слоя (октета) два атома кислорода образуют две общие электронные пары, формируя двойную связь. У каждого атома кислорода также остается по две неподеленные электронные пары.
·· ·· :O::O: ·· ··
Графическая формула:
O=O
Направление смещения электронной плотности:
Связь образована двумя одинаковыми атомами (кислород), их электроотрицательности равны. Поэтому электронная плотность общих электронных пар распределена симметрично между атомами, и смещения не происходит.
Тип химической связи:
Ковалентная неполярная связь.
Ответ: Электронная формула $O_2$ представляет собой два атома кислорода, соединенных двойной связью, с двумя неподеленными парами у каждого атома. Графическая формула: $O=O$. Смещение электронной плотности отсутствует. Тип связи - ковалентная неполярная.
Вещество: $Cl_2O$ (оксид хлора(I))
Электронная формула (формула Льюиса):
Центральным атомом является кислород (6 валентных электронов), который образует по одной одинарной связи с двумя атомами хлора (по 7 валентных электронов у каждого). Для завершения октетов у атома кислорода остаются две неподеленные электронные пары, а у каждого атома хлора - по три.
·· ·· :O: ·· :Cl: ·· :Cl: ·· ··
Графическая формула:
Молекула имеет угловое строение из-за наличия неподеленных электронных пар у центрального атома кислорода.
Cl-O-Cl
Направление смещения электронной плотности:
Электроотрицательность кислорода (≈3,44 по Полингу) больше электроотрицательности хлора (≈3,16). Поэтому общие электронные пары в связях $Cl-O$ смещены от атомов хлора к более электроотрицательному атому кислорода.
$Cl \rightarrow O \leftarrow Cl$
Тип химической связи:
Ковалентная полярная связь.
Ответ: В молекуле $Cl_2O$ атом кислорода связан с двумя атомами хлора одинарными связями. Электронная формула показывает наличие 2 неподеленных пар у кислорода и по 3 у каждого хлора. Графическая формула: $Cl-O-Cl$. Электронная плотность смещена от атомов хлора к атому кислороду. Тип связи - ковалентная полярная.
Вещество: $H_2O_2$ (пероксид водорода)
Электронная формула (формула Льюиса):
Два атома кислорода соединены между собой одинарной связью, и каждый из них, в свою очередь, связан с одним атомом водорода. У каждого атома кислорода имеется по две неподеленные электронные пары.
·· ·· H:O : O:H ·· ··
Графическая формула:
H-O-O-H
Направление смещения электронной плотности:
В молекуле присутствуют два типа связей: $O-O$ и $O-H$.
- Связь $O-O$: образована одинаковыми атомами, является ковалентной неполярной, смещения электронной плотности нет.
- Связь $O-H$: электроотрицательность кислорода (≈3,44) значительно выше электроотрицательности водорода (≈2,20). Электронная плотность смещена от атома водорода к атому кислорода.
$H \rightarrow O - O \leftarrow H$
Тип химической связи:
В молекуле пероксида водорода присутствуют два типа ковалентной связи: неполярная ($O-O$) и полярная ($O-H$).
Ответ: Электронная формула $H_2O_2$ - $H:O:O:H$ с двумя неподеленными парами у каждого атома кислорода. Графическая - $H-O-O-H$. В связи $O-H$ электронная плотность смещена к кислороду, в связи $O-O$ смещения нет. Типы связей: ковалентная полярная ($O-H$) и ковалентная неполярная ($O-O$).
Решение:
Вещество: $P_2$ (дифосфор)
Электронная формула (формула Льюиса):
Атом фосфора (P) находится в 15-й группе и имеет 5 валентных электронов. Аналогично молекуле азота $N_2$, два атома фосфора образуют тройную связь (три общие электронные пары), и у каждого атома остается по одной неподеленной электронной паре для достижения октета.
:P:::P:
Графическая формула:
P≡P
Направление смещения электронной плотности:
Связь образована двумя одинаковыми атомами фосфора, их электроотрицательности равны. Смещение электронной плотности отсутствует.
Тип химической связи:
Ковалентная неполярная связь.
Ответ: Электронная формула $P_2$ - $:P:::P:$, графическая - $P \equiv P$. Смещение электронной плотности отсутствует. Тип связи - ковалентная неполярная.
Вещество: $PH_3$ (фосфин)
Электронная формула (формула Льюиса):
Центральный атом - фосфор (5 валентных электронов), он образует три одинарные связи с тремя атомами водорода (по 1 валентному электрону). У атома фосфора остается одна неподеленная электронная пара.
·· H:P:H : H
Графическая формула:
Молекула имеет форму тригональной пирамиды.
H | H-P-H
Направление смещения электронной плотности:
Электроотрицательности фосфора (≈2,19) и водорода (≈2,20) очень близки. Разница незначительна, поэтому связь $P-H$ является очень слабо полярной. Формально, электронная плотность незначительно смещена от атома фосфора к атому водорода.
$P \rightarrow H$
Тип химической связи:
Ковалентная слабополярная связь (часто рассматривается как практически неполярная).
Ответ: В молекуле $PH_3$ атом фосфора соединен с тремя атомами водорода, на атоме фосфора есть неподеленная электронная пара. Графическая формула имеет вид тригональной пирамиды. Электронная плотность в связях $P-H$ смещена незначительно к водороду. Тип связи - ковалентная слабополярная.
Вещество: $PCl_3$ (трихлорид фосфора)
Электронная формула (формула Льюиса):
Центральный атом - фосфор, который образует три одинарные связи с тремя атомами хлора. У фосфора остается одна неподеленная электронная пара, а у каждого атома хлора - по три.
·· :Cl:P:Cl: ·· :Cl: ·· ··(c неподеленными парами у всех атомов хлора)
Графическая формула:
Молекула, как и $PH_3$, имеет форму тригональной пирамиды.
Cl |Cl-P-Cl
Направление смещения электронной плотности:
Электроотрицательность хлора (≈3,16) значительно выше электроотрицательности фосфора (≈2,19). Поэтому общие электронные пары в связях $P-Cl$ сильно смещены от атома фосфора к более электроотрицательным атомам хлора.
$P \rightarrow Cl$
Тип химической связи:
Ковалентная полярная связь.
Ответ: В молекуле $PCl_3$ атом фосфора связан с тремя атомами хлора, на фосфоре есть неподеленная пара. Графическая формула имеет вид тригональной пирамиды. Электронная плотность в связях $P-Cl$ смещена от фосфора к хлору. Тип связи - ковалентная полярная.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-13 расположенного на странице 84 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-13 (с. 84), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















