Номер 7-14, страница 84 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.1. Характер связи в химических соединениях - номер 7-14, страница 84.
№7-14 (с. 84)
Условие. №7-14 (с. 84)
скриншот условия

7-14. Составьте электронные и графические формулы веществ:
а) $CH_4$,
б) $BeCl_2$,
в) $BF_3$.
Укажите направление смещения электронной плотности и определите тип химической связи.
Решение. №7-14 (с. 84)
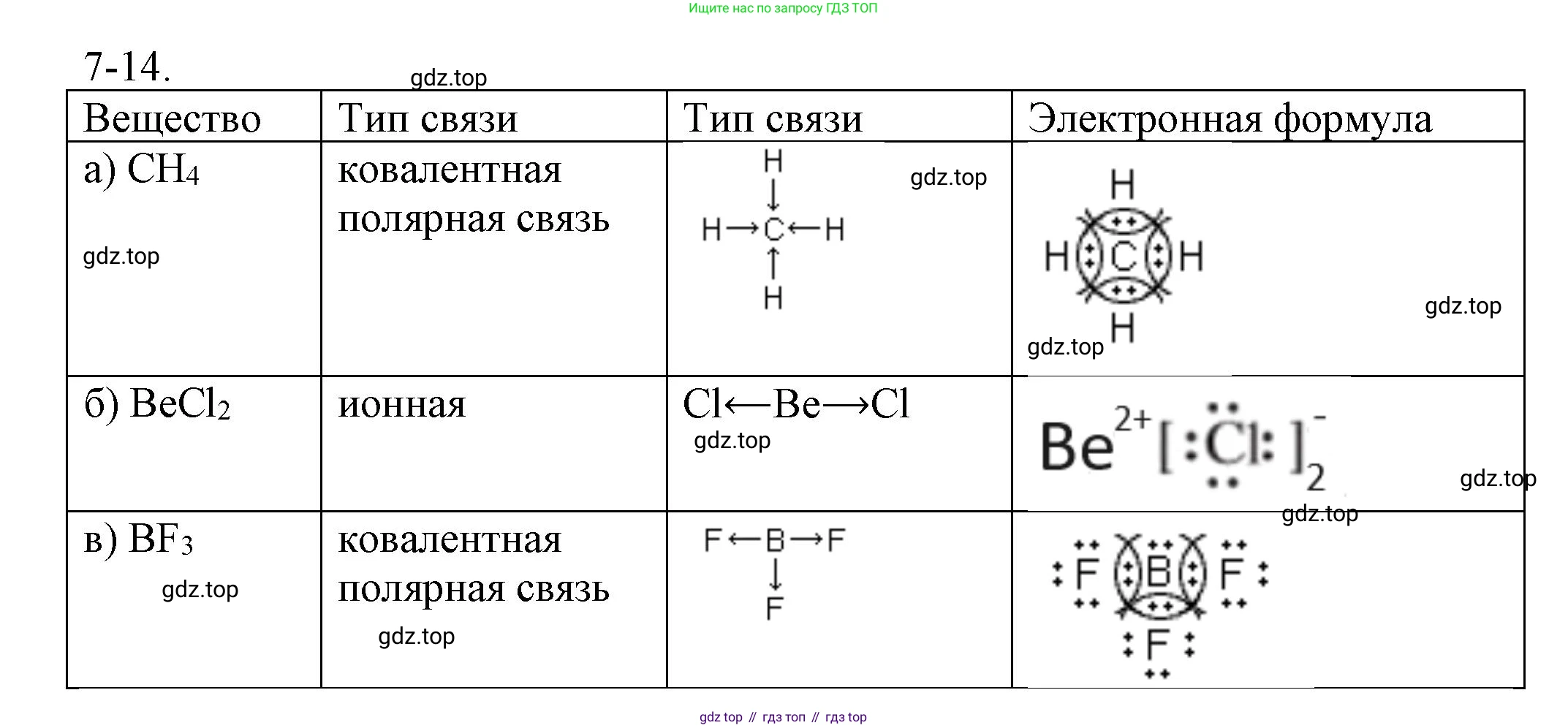
Решение 2. №7-14 (с. 84)
а) $CH_4$ (метан)
Решение:
Атом углерода (C) находится в 14-й группе (IVA) периодической системы и имеет 4 валентных электрона ($2s^22p^2$). Атом водорода (H) находится в 1-й группе (IA) и имеет 1 валентный электрон ($1s^1$).
Электронная формула (формула Льюиса):
Центральным атомом является углерод. Он образует четыре одинарные связи с четырьмя атомами водорода. В результате атом углерода достигает стабильного октета (8 электронов), а каждый атом водорода — стабильного дублета (2 электрона).
H
..
H : C : H
..
H
Графическая формула:
Каждая общая электронная пара (химическая связь) изображается черточкой.
H
|
H - C - H
|
H
Направление смещения электронной плотности и тип связи:
Электроотрицательность углерода (2,55) немного больше электроотрицательности водорода (2,20). Разница электроотрицательностей $Δχ = 2.55 - 2.20 = 0.35$. Поэтому электронная плотность в каждой связи C-H смещена от атома водорода к атому углерода. Это можно изобразить стрелкой $H \rightarrow C$ или указанием частичных зарядов $H^{\delta+} - C^{\delta-}$.
Связь между атомами с разной, но близкой электроотрицательностью, является ковалентной полярной.
Ответ: Электронная и графическая формулы представлены выше. Направление смещения электронной плотности в каждой связи — от атома водорода к атому углерода. Тип химической связи — ковалентная полярная.
б) $BeCl_2$ (хлорид бериллия)
Решение:
Атом бериллия (Be) находится во 2-й группе (IIA) и имеет 2 валентных электрона ($2s^2$). Атом хлора (Cl) находится в 17-й группе (VIIA) и имеет 7 валентных электронов ($3s^23p^5$).
Электронная формула (формула Льюиса):
Центральным атомом является бериллий. Он образует две одинарные связи с двумя атомами хлора. У каждого атома хлора имеется по 3 неподеленные электронные пары. Атом бериллия в данном соединении является исключением из правила октета, так как его валентная оболочка содержит только 4 электрона.
.. ..
: Cl : Be : Cl :
¨ ¨
Графическая формула:
Cl - Be - Cl
Направление смещения электронной плотности и тип связи:
Электроотрицательность хлора (3,16) значительно больше электроотрицательности бериллия (1,57). Разница электроотрицательностей $Δχ = 3.16 - 1.57 = 1.59$. Электронная плотность в каждой связи Be-Cl сильно смещена от атома бериллия к атому хлора. Направление смещения: $Be \rightarrow Cl$ или $Be^{\delta+} - Cl^{\delta-}$.
Связь между атомами с существенной разницей в электроотрицательности является ковалентной полярной.
Ответ: Электронная и графическая формулы представлены выше. Направление смещения электронной плотности в каждой связи — от атома бериллия к атому хлора. Тип химической связи — ковалентная полярная.
в) $BF_3$ (фторид бора)
Решение:
Атом бора (B) находится в 13-й группе (IIIA) и имеет 3 валентных электрона ($2s^22p^1$). Атом фтора (F) находится в 17-й группе (VIIA) и имеет 7 валентных электронов ($2s^22p^5$).
Электронная формула (формула Льюиса):
Центральным атомом является бор. Он образует три одинарные связи с тремя атомами фтора. У каждого атома фтора имеется по 3 неподеленные электронные пары. Атом бора в этом соединении также является исключением из правила октета, имея на валентной оболочке 6 электронов.
:F:
¨
:F: : B : :F:
¨ ¨ ¨
Графическая формула:
F
|
F - B - F
Направление смещения электронной плотности и тип связи:
Фтор — самый электроотрицательный элемент (3,98), его электроотрицательность намного больше, чем у бора (2,04). Разница электроотрицательностей $Δχ = 3.98 - 2.04 = 1.94$ очень велика. Электронная плотность в каждой связи B-F сильно смещена от атома бора к атому фтора. Направление смещения: $B \rightarrow F$ или $B^{\delta+} - F^{\delta-}$.
Связь является ковалентной сильно полярной.
Ответ: Электронная и графическая формулы представлены выше. Направление смещения электронной плотности в каждой связи — от атома бора к атому фтора. Тип химической связи — ковалентная полярная.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-14 расположенного на странице 84 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-14 (с. 84), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















