Номер 7-12, страница 84 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.1. Характер связи в химических соединениях - номер 7-12, страница 84.
№7-12 (с. 84)
Условие. №7-12 (с. 84)
скриншот условия

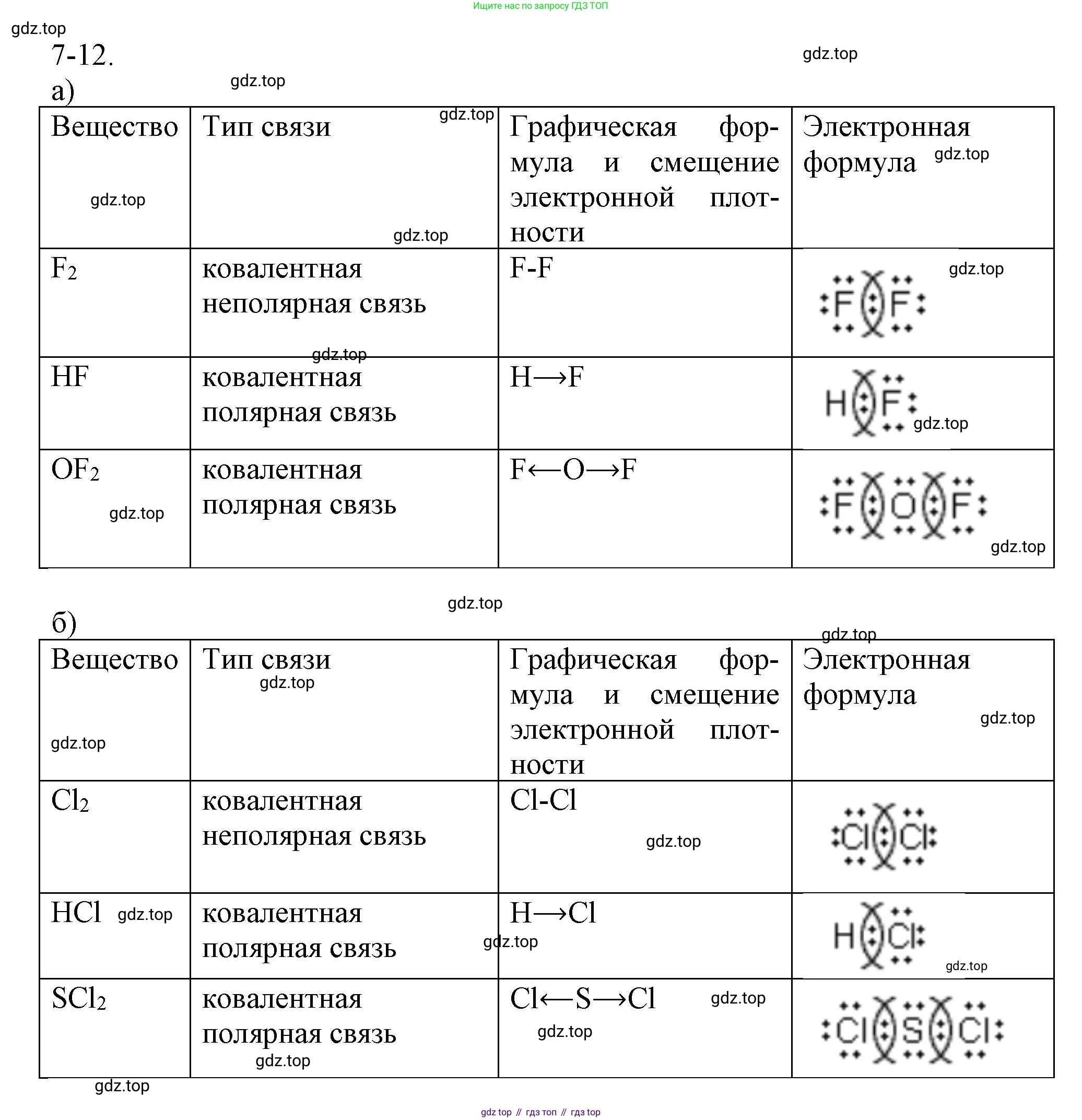
7-12. Составьте электронные и графические формулы веществ:
а) $F_2$, $HF$, $OF_2$;
б) $Cl_2$, $HCl$, $SCl_2$. Укажите направление смещения электронной плотности и определите тип химической связи.
Решение. №7-12 (с. 84)
Решение 2. №7-12 (с. 84)
Молекула фтора $F_2$
Атом фтора (F) имеет 7 валентных электронов на внешнем уровне ($2s^22p^5$). Для завершения внешней электронной оболочки до стабильного октета (8 электронов) каждому атому фтора не хватает одного электрона. Поэтому два атома фтора образуют одну общую электронную пару, формируя одинарную связь.
Электронная формула (формула Льюиса): $:\ddot{F}:\ddot{F}:$
Графическая (структурная) формула: $:\ddot{F}-\ddot{F}:$
Смещение электронной плотности и тип связи:
Молекула образована атомами одного и того же химического элемента, их электроотрицательности равны. Поэтому общая электронная пара не смещается ни к одному из атомов, а распределена симметрично. Смещение электронной плотности отсутствует. Такая связь называется ковалентной неполярной.
Молекула фтороводорода $HF$
Атом водорода (H) имеет 1 валентный электрон ($1s^1$). Атом фтора (F) имеет 7 валентных электронов ($2s^22p^5$). Для образования устойчивой электронной оболочки (дуплета у водорода и октета у фтора) атомы образуют одну общую электронную пару.
Электронная формула: $H:\ddot{F}:$
Графическая формула: $H-\ddot{F}:$
Смещение электронной плотности и тип связи:
Фтор — самый электроотрицательный элемент. Его электроотрицательность (ЭО) значительно выше, чем у водорода. Из-за разницы в ЭО общая электронная пара сильно смещена в сторону атома фтора. На атоме фтора возникает частичный отрицательный заряд ($\delta^-$), а на атоме водорода — частичный положительный заряд ($\delta^+$). Направление смещения: $H^{\delta+} \rightarrow F^{\delta-}$. Связь, образованная атомами разных неметаллов со смещением электронной плотности, называется ковалентной полярной.
Молекула дифторида кислорода $OF_2$
Центральным атомом является кислород (O), имеющий 6 валентных электронов ($2s^22p^4$) и способный образовать две связи. Атом фтора (F) имеет 7 валентных электронов ($2s^22p^5$) и образует одну связь. Атом кислорода образует две одинарные связи с двумя атомами фтора. У кислорода остаются две неподеленные электронные пары, у каждого фтора - по три.
Электронная формула: $:\ddot{F}:\ddot{O}:\ddot{F}:$
Графическая формула: $:\ddot{F}-\ddot{O}-\ddot{F}:$
Смещение электронной плотности и тип связи:
Электроотрицательность фтора (3.98) больше электроотрицательности кислорода (3.44). Поэтому в каждой связи O–F общая электронная пара смещена к атому фтора. На атомах фтора возникают частичные отрицательные заряды ($\delta^-$), а на атоме кислорода — частичный положительный заряд ($2\delta^+$). Направление смещения в каждой связи: $O \rightarrow F$. Связи являются ковалентными полярными.
Ответ: В молекуле $F_2$ химическая связь ковалентная неполярная, смещение электронной плотности отсутствует. В молекулах $HF$ и $OF_2$ химические связи ковалентные полярные; электронная плотность смещена к более электроотрицательному атому фтора.
б) $Cl_2$, $HCl$, $SCl_2$Молекула хлора $Cl_2$
Атом хлора (Cl) — галоген, имеет 7 валентных электронов ($3s^23p^5$). Для достижения октета каждому атому хлора не хватает одного электрона. Два атома хлора образуют одну общую электронную пару, формируя одинарную связь.
Электронная формула: $:\ddot{Cl}:\ddot{Cl}:$
Графическая формула: $:\ddot{Cl}-\ddot{Cl}:$
Смещение электронной плотности и тип связи:
Молекула образована одинаковыми атомами неметалла, их электроотрицательности равны. Общая электронная пара располагается симметрично относительно ядер обоих атомов. Смещение электронной плотности отсутствует. Связь является ковалентной неполярной.
Молекула хлороводорода $HCl$
Атом водорода (H) имеет 1 валентный электрон ($1s^1$), атом хлора (Cl) — 7 валентных электронов ($3s^23p^5$). Атомы образуют одну общую электронную пару для достижения стабильных электронных конфигураций (дуплета у H, октета у Cl).
Электронная формула: $H:\ddot{Cl}:$
Графическая формула: $H-\ddot{Cl}:$
Смещение электронной плотности и тип связи:
Хлор более электроотрицателен (3.16), чем водород (2.20). Общая электронная пара смещена к атому хлора. На атоме хлора возникает частичный отрицательный заряд ($\delta^-$), а на атоме водорода — частичный положительный ($\delta^+$). Направление смещения: $H^{\delta+} \rightarrow Cl^{\delta-}$. Связь ковалентная полярная.
Молекула дихлорида серы $SCl_2$
Центральным атомом является сера (S), имеющая 6 валентных электронов ($3s^23p^4$). Атом хлора (Cl) имеет 7 валентных электронов ($3s^23p^5$). Атом серы образует две одинарные связи с двумя атомами хлора. У серы остаются две неподеленные электронные пары, у каждого атома хлора - по три.
Электронная формула: $:\ddot{Cl}:\ddot{S}:\ddot{Cl}:$
Графическая формула: $:\ddot{Cl}-\ddot{S}-\ddot{Cl}:$
Смещение электронной плотности и тип связи:
Электроотрицательность хлора (3.16) выше, чем у серы (2.58). В каждой связи S–Cl электронная плотность смещена к атому хлора. На атомах хлора возникают частичные отрицательные заряды ($\delta^-$), а на атоме серы — частичный положительный заряд ($2\delta^+$). Направление смещения в каждой связи: $S \rightarrow Cl$. Связи являются ковалентными полярными.
Ответ: В молекуле $Cl_2$ химическая связь ковалентная неполярная, смещение электронной плотности отсутствует. В молекулах $HCl$ и $SCl_2$ химические связи ковалентные полярные; электронная плотность смещена к более электроотрицательному атому хлора.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-12 расположенного на странице 84 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-12 (с. 84), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















