Номер 7-35, страница 90 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.3. Окислительно-восстановительные реакции - номер 7-35, страница 90.
№7-35 (с. 90)
Условие. №7-35 (с. 90)
скриншот условия

7-35. Из данного списка выберите схемы окислительно-восстановительных реакций, укажите окислитель и восстановитель:
а) $K_2Cr_2O_7 + K_2SO_3 + H_2SO_4 \rightarrow K_2SO_4 + Cr_2(SO_4)_3 + H_2O$
б) $K_2CrO_4 + H_2SO_4 \rightarrow K_2SO_4 + K_2Cr_2O_7 + H_2O$
в) $KCrO_2 + Br_2 + KOH \rightarrow K_2CrO_4 + KBr + H_2O$
г) $KOH + H_2CrO_4 \rightarrow K_2CrO_4 + H_2O$
Решение. №7-35 (с. 90)
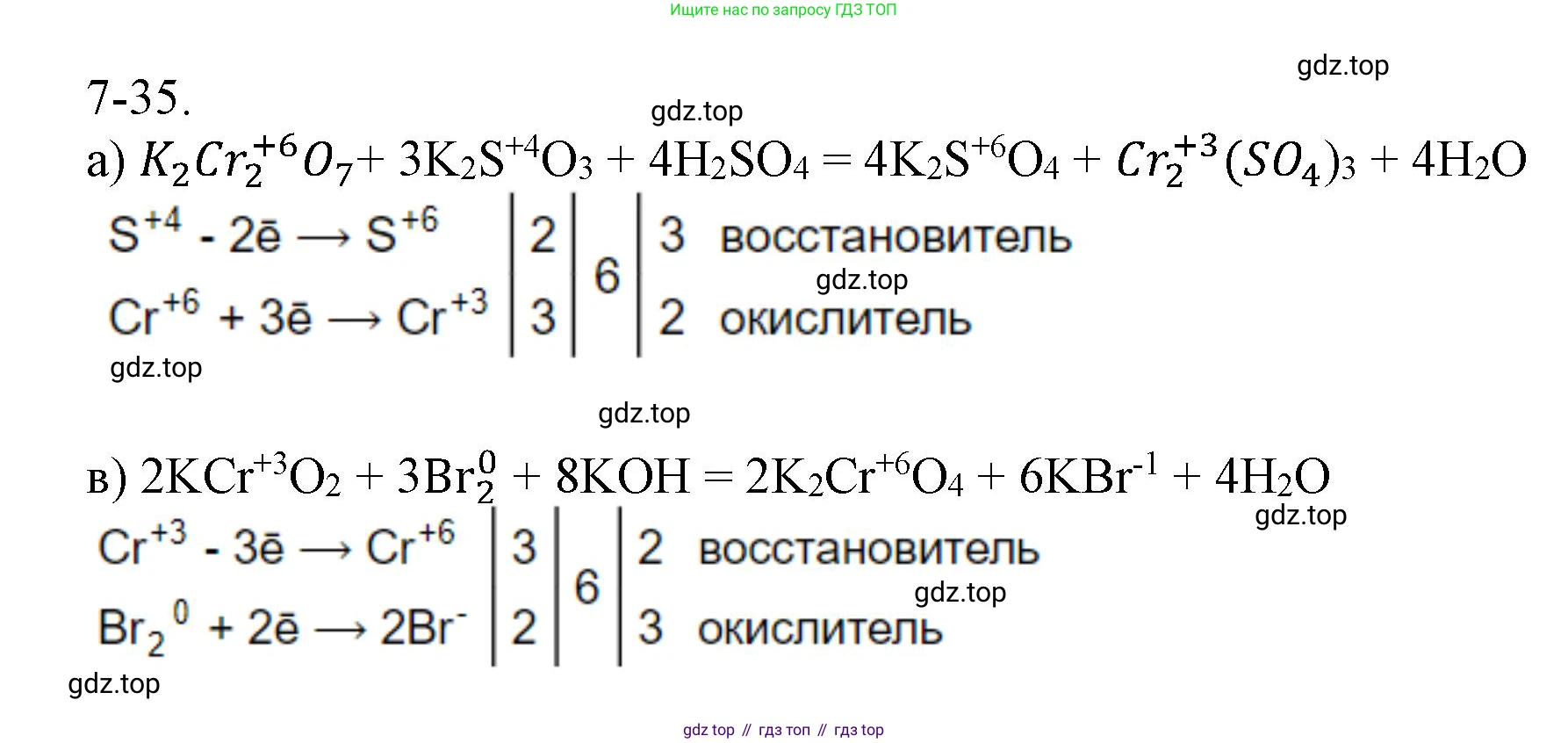
Решение 2. №7-35 (с. 90)
Окислительно-восстановительными (ОВР) называются реакции, в ходе которых изменяются степени окисления одного или нескольких элементов. Для определения, является ли реакция ОВР, необходимо расставить степени окисления всех элементов в реагентах и продуктах.
а) $K_2Cr_2O_7 + K_2SO_3 + H_2SO_4 \rightarrow K_2SO_4 + Cr_2(SO_4)_3 + H_2O$
Для того чтобы определить, является ли реакция окислительно-восстановительной, необходимо проанализировать изменение степеней окисления элементов.
Определим степени окисления элементов в реагентах:
В $K_2\overset{+6}{Cr_2}\overset{-2}{O_7}$ (дихромат калия): калий $K^{+1}$, кислород $O^{-2}$, следовательно, хром $Cr^{+6}$ $(2 \cdot (+1) + 2x + 7 \cdot (-2) = 0 \Rightarrow 2x = 12 \Rightarrow x = +6)$.
В $K_2\overset{+4}{S}\overset{-2}{O_3}$ (сульфит калия): калий $K^{+1}$, кислород $O^{-2}$, следовательно, сера $S^{+4}$ $(2 \cdot (+1) + x + 3 \cdot (-2) = 0 \Rightarrow x = +4)$.
В $H_2\overset{+6}{S}\overset{-2}{O_4}$ (серная кислота): водород $H^{+1}$, кислород $O^{-2}$, следовательно, сера $S^{+6}$.
Определим степени окисления элементов в продуктах:
В $K_2\overset{+6}{S}\overset{-2}{O_4}$ (сульфат калия): калий $K^{+1}$, кислород $O^{-2}$, сера $S^{+6}$.
В $\overset{+3}{Cr_2}(\overset{+6}{S}\overset{-2}{O_4})_3$ (сульфат хрома(III)): сульфат-ион $(SO_4)^{2-}$, в котором сера $S^{+6}$, следовательно, хром $Cr^{+3}$ $(2x + 3 \cdot (-2) = 0 \Rightarrow 2x = 6 \Rightarrow x = +3)$.
В $H_2O$ (вода): водород $H^{+1}$, кислород $O^{-2}$.
Сравним степени окисления:
Хром изменил степень окисления с $+6$ (в $K_2Cr_2O_7$) на $+3$ (в $Cr_2(SO_4)_3$): $2Cr^{+6} + 6e^- \rightarrow 2Cr^{+3}$. Происходит процесс восстановления.
Сера из сульфита калия изменила степень окисления с $+4$ (в $K_2SO_3$) на $+6$ (в $K_2SO_4$): $S^{+4} - 2e^- \rightarrow S^{+6}$. Происходит процесс окисления.
Поскольку степени окисления хрома и серы изменились, данная реакция является окислительно-восстановительной.
Вещество, в котором элемент понижает свою степень окисления (принимает электроны), является окислителем. $K_2Cr_2O_7$ – окислитель (за счет $Cr^{+6}$).
Вещество, в котором элемент повышает свою степень окисления (отдает электроны), является восстановителем. $K_2SO_3$ – восстановитель (за счет $S^{+4}$).
Ответ: Реакция является окислительно-восстановительной. Окислитель – $K_2Cr_2O_7$, восстановитель – $K_2SO_3$.
б) $K_2CrO_4 + H_2SO_4 \rightarrow K_2SO_4 + K_2Cr_2O_7 + H_2O$
Определим степени окисления элементов в реагентах и продуктах.
В $K_2\overset{+6}{Cr}O_4$ (хромат калия): $Cr^{+6}$.
В $H_2\overset{+6}{S}O_4$ (серная кислота): $S^{+6}$.
В $K_2\overset{+6}{S}O_4$ (сульфат калия): $S^{+6}$.
В $K_2\overset{+6}{Cr_2}O_7$ (дихромат калия): $Cr^{+6}$.
Степени окисления всех элементов (K, Cr, O, H, S) в ходе реакции не изменяются. Эта реакция является переходом хромата в дихромат в кислой среде и относится к реакциям ионного обмена.
Ответ: Реакция не является окислительно-восстановительной.
в) $KCrO_2 + Br_2 + KOH \rightarrow K_2CrO_4 + KBr + H_2O$
Проанализируем изменение степеней окисления элементов.
Степени окисления в реагентах:
В $K\overset{+3}{Cr}\overset{-2}{O_2}$ (хромит калия): калий $K^{+1}$, кислород $O^{-2}$, следовательно, хром $Cr^{+3}$ $(+1 + x + 2 \cdot (-2) = 0 \Rightarrow x = +3)$.
В $\overset{0}{Br_2}$ (бром): бром $Br^0$.
В $KOH$ (гидроксид калия): $K^{+1}, O^{-2}, H^{+1}$.
Степени окисления в продуктах:
В $K_2\overset{+6}{Cr}\overset{-2}{O_4}$ (хромат калия): калий $K^{+1}$, кислород $O^{-2}$, следовательно, хром $Cr^{+6}$ $(2 \cdot (+1) + x + 4 \cdot (-2) = 0 \Rightarrow x = +6)$.
В $K\overset{-1}{Br}$ (бромид калия): калий $K^{+1}$, следовательно, бром $Br^{-1}$.
В $H_2O$ (вода): $H^{+1}, O^{-2}$.
Сравним степени окисления:
Хром повышает степень окисления с $+3$ (в $KCrO_2$) до $+6$ (в $K_2CrO_4$): $Cr^{+3} - 3e^- \rightarrow Cr^{+6}$ (окисление).
Бром понижает степень окисления с $0$ (в $Br_2$) до $-1$ (в $KBr$): $Br_2^0 + 2e^- \rightarrow 2Br^{-1}$ (восстановление).
Так как происходит изменение степеней окисления, реакция является окислительно-восстановительной.
$KCrO_2$ (за счет $Cr^{+3}$) отдает электроны и является восстановителем.
$Br_2$ (за счет $Br^0$) принимает электроны и является окислителем.
Ответ: Реакция является окислительно-восстановительной. Окислитель – $Br_2$, восстановитель – $KCrO_2$.
г) $KOH + H_2CrO_4 \rightarrow K_2CrO_4 + H_2O$
Определим степени окисления элементов в реагентах и продуктах.
В $KOH$ (гидроксид калия): $K^{+1}, O^{-2}, H^{+1}$.
В $H_2\overset{+6}{Cr}O_4$ (хромовая кислота): $Cr^{+6}$.
В $K_2\overset{+6}{Cr}O_4$ (хромат калия): $Cr^{+6}$.
В $H_2O$ (вода): $H^{+1}, O^{-2}$.
Степени окисления всех элементов в ходе реакции не меняются. Это реакция нейтрализации между кислотой ($H_2CrO_4$) и основанием ($KOH$), которая не сопровождается переносом электронов.
Ответ: Реакция не является окислительно-восстановительной.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-35 расположенного на странице 90 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-35 (с. 90), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















