Номер 7-39, страница 91 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.3. Окислительно-восстановительные реакции - номер 7-39, страница 91.
№7-39 (с. 91)
Условие. №7-39 (с. 91)
скриншот условия

7-39. По данным схемам составьте схемы электронного баланса и уравнения окислительно-восстановительных реакций:
а) $PbO_2 + Al \rightarrow Al_2O_3 + Pb$
б) $H_2S + O_2 \rightarrow S + H_2O$
в) $KClO_3 + S \rightarrow SO_2 + KCl$
г) $H_2SO_4 + Na \rightarrow Na_2SO_4 + H_2S + H_2O$
Решение. №7-39 (с. 91)
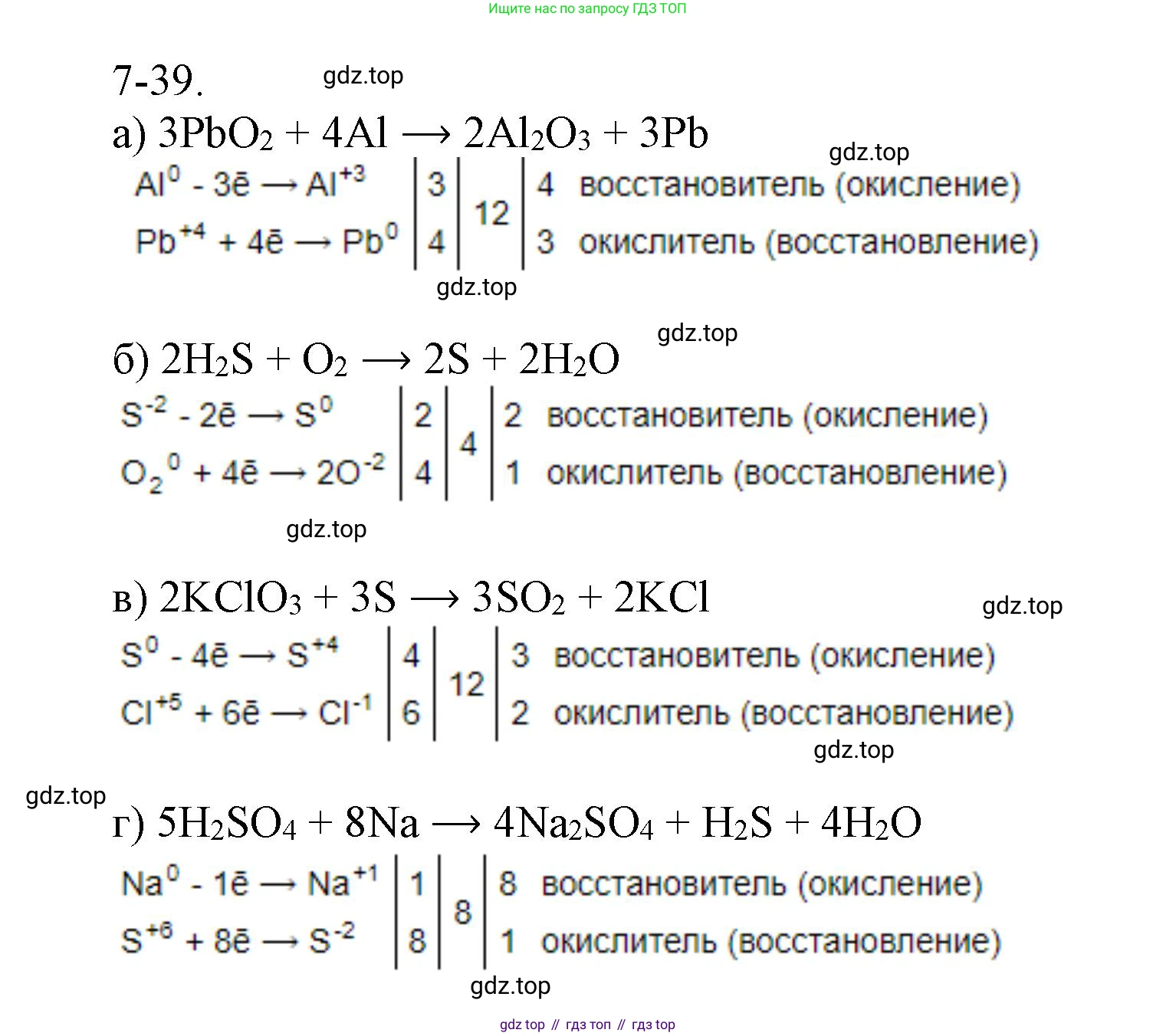
Решение 2. №7-39 (с. 91)
а)
Решение.
Рассмотрим схему реакции: $PbO_2 + Al \rightarrow Al_2O_3 + Pb$.
Определим степени окисления элементов до и после реакции:
$ \stackrel{+4}{Pb} \stackrel{-2}{O_2} + \stackrel{0}{Al} \rightarrow \stackrel{+3}{Al_2} \stackrel{-2}{O_3} + \stackrel{0}{Pb} $
Свинец ($Pb$) понижает свою степень окисления с +4 до 0, следовательно, он является окислителем и подвергается восстановлению. Алюминий ($Al$) повышает свою степень окисления с 0 до +3, следовательно, он является восстановителем и подвергается окислению.
Составим схему электронного баланса:
| $Pb^{+4} + 4e^- \rightarrow Pb^0$ | 3 | окислитель, процесс восстановления |
| $Al^0 - 3e^- \rightarrow Al^{+3}$ | 4 | восстановитель, процесс окисления |
Наименьшее общее кратное для чисел отданных и принятых электронов (4 и 3) равно 12. Поэтому первый процесс домножаем на 3, а второй — на 4. Эти числа являются коэффициентами для соответствующих веществ в уравнении.
Расставим коэффициенты и получим уравнение реакции:
$3PbO_2 + 4Al \rightarrow 2Al_2O_3 + 3Pb$
Ответ: Схема электронного баланса:
$Pb^{+4} + 4e^- \rightarrow Pb^0$ | 3
$Al^0 - 3e^- \rightarrow Al^{+3}$ | 4
Уравнение реакции: $3PbO_2 + 4Al = 2Al_2O_3 + 3Pb$.
б)
Решение.
Рассмотрим схему реакции: $H_2S + O_2 \rightarrow S + H_2O$.
Определим степени окисления элементов до и после реакции:
$ \stackrel{+1}{H_2} \stackrel{-2}{S} + \stackrel{0}{O_2} \rightarrow \stackrel{0}{S} + \stackrel{+1}{H_2} \stackrel{-2}{O} $
Сера ($S$) повышает свою степень окисления с -2 до 0, следовательно, сероводород ($H_2S$) является восстановителем. Кислород ($O$) понижает свою степень окисления с 0 до -2, следовательно, он является окислителем.
Составим схему электронного баланса:
| $S^{-2} - 2e^- \rightarrow S^0$ | 2 | восстановитель, процесс окисления |
| $O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1 | окислитель, процесс восстановления |
Наименьшее общее кратное для 2 и 4 равно 4. Домножаем первую полуреакцию на 2, вторую — на 1.
Расставим коэффициенты и получим уравнение реакции:
$2H_2S + O_2 \rightarrow 2S + 2H_2O$
Ответ: Схема электронного баланса:
$S^{-2} - 2e^- \rightarrow S^0$ | 2
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1
Уравнение реакции: $2H_2S + O_2 = 2S + 2H_2O$.
в)
Решение.
Рассмотрим схему реакции: $KClO_3 + S \rightarrow SO_2 + KCl$.
Определим степени окисления элементов до и после реакции:
$ \stackrel{+1}{K} \stackrel{+5}{Cl} \stackrel{-2}{O_3} + \stackrel{0}{S} \rightarrow \stackrel{+4}{S} \stackrel{-2}{O_2} + \stackrel{+1}{K} \stackrel{-1}{Cl} $
Хлор ($Cl$) понижает свою степень окисления с +5 до -1, следовательно, хлорат калия ($KClO_3$) является окислителем. Сера ($S$) повышает свою степень окисления с 0 до +4, следовательно, она является восстановителем.
Составим схему электронного баланса:
| $Cl^{+5} + 6e^- \rightarrow Cl^{-1}$ | 2 | окислитель, процесс восстановления |
| $S^0 - 4e^- \rightarrow S^{+4}$ | 3 | восстановитель, процесс окисления |
Наименьшее общее кратное для 6 и 4 равно 12. Домножаем первую полуреакцию на 2, вторую — на 3.
Расставим коэффициенты и получим уравнение реакции:
$2KClO_3 + 3S \rightarrow 3SO_2 + 2KCl$
Ответ: Схема электронного баланса:
$Cl^{+5} + 6e^- \rightarrow Cl^{-1}$ | 2
$S^0 - 4e^- \rightarrow S^{+4}$ | 3
Уравнение реакции: $2KClO_3 + 3S = 3SO_2 + 2KCl$.
г)
Решение.
Рассмотрим схему реакции: $H_2SO_4 + Na \rightarrow Na_2SO_4 + H_2S + H_2O$.
Определим степени окисления элементов до и после реакции:
$ \stackrel{+1}{H_2} \stackrel{+6}{S} \stackrel{-2}{O_4} + \stackrel{0}{Na} \rightarrow \stackrel{+1}{Na_2} \stackrel{+6}{S} \stackrel{-2}{O_4} + \stackrel{+1}{H_2} \stackrel{-2}{S} + \stackrel{+1}{H_2} \stackrel{-2}{O} $
Сера ($S$) в серной кислоте понижает свою степень окисления с +6 до -2 (в $H_2S$), следовательно, серная кислота ($H_2SO_4$) является окислителем. Натрий ($Na$) повышает свою степень окисления с 0 до +1, следовательно, он является восстановителем. Часть серной кислоты не меняет степень окисления и образует соль $Na_2SO_4$.
Составим схему электронного баланса:
| $S^{+6} + 8e^- \rightarrow S^{-2}$ | 1 | окислитель, процесс восстановления |
| $Na^0 - 1e^- \rightarrow Na^{+1}$ | 8 | восстановитель, процесс окисления |
Наименьшее общее кратное для 8 и 1 равно 8. Домножаем первую полуреакцию на 1, вторую — на 8.
Расставим коэффициенты. Перед натрием ставим 8, перед $H_2S$ – 1. Затем уравниваем натрий справа, поставив 4 перед $Na_2SO_4$. Далее уравниваем серу: справа 4+1=5 атомов серы, значит, слева перед $H_2SO_4$ ставим 5. В последнюю очередь уравниваем водород и кислород, поставив 4 перед $H_2O$.
Итоговое уравнение реакции:
$5H_2SO_4 + 8Na \rightarrow 4Na_2SO_4 + H_2S + 4H_2O$
Ответ: Схема электронного баланса:
$S^{+6} + 8e^- \rightarrow S^{-2}$ | 1
$Na^0 - 1e^- \rightarrow Na^{+1}$ | 8
Уравнение реакции: $5H_2SO_4 + 8Na = 4Na_2SO_4 + H_2S + 4H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-39 расположенного на странице 91 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-39 (с. 91), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.















