Номер 7-46, страница 92 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.3. Окислительно-восстановительные реакции - номер 7-46, страница 92.
№7-46 (с. 92)
Условие. №7-46 (с. 92)
скриншот условия

7-46. К схемам реакций, приведенным в задаче 7-44, составьте электронный баланс, указав окислитель и восстановитель, окисление и восстановление. Расставьте коэффициенты.
Решение. №7-46 (с. 92)
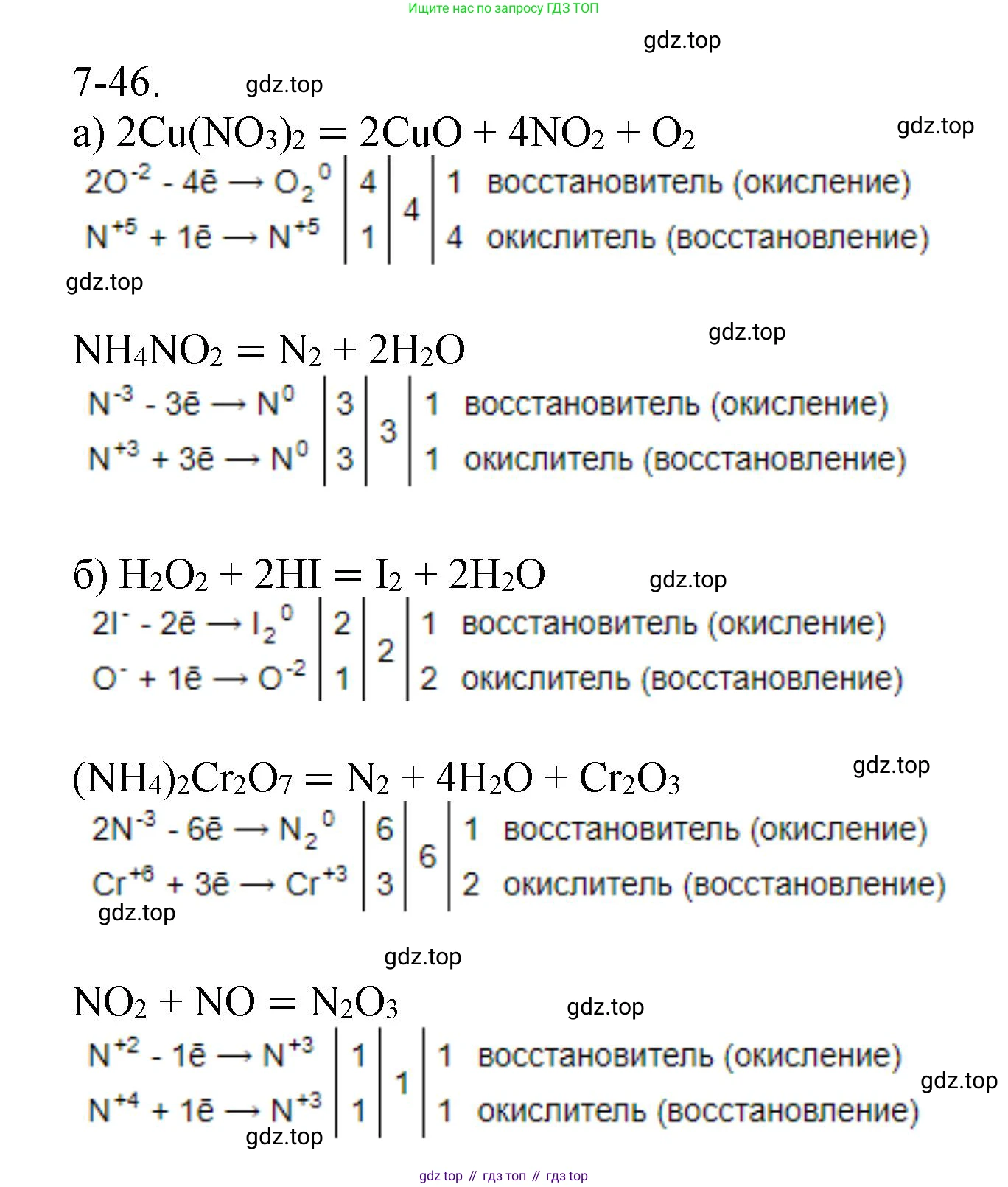
Решение 2. №7-46 (с. 92)
I₂ + HNO₃ → HIO₃ + NO₂ + H₂O
Решение:
1. Определим степени окисления элементов, которые их изменяют в ходе реакции:
$ \stackrel{0}{I_2} + H\stackrel{+5}{N}O_3 \rightarrow H\stackrel{+5}{I}O_3 + \stackrel{+4}{N}O_2 + H_2O $
Йод ($I$) повышает свою степень окисления с 0 до +5.
Азот ($N$) понижает свою степень окисления с +5 до +4.
2. Составим электронный баланс. Йод является восстановителем (окисляется), азотная кислота за счет азота $N^{+5}$ является окислителем (восстанавливается).
$ 2\stackrel{0}{I} - 10e^- \rightarrow 2\stackrel{+5}{I} $ | 1 | процесс окисления (восстановитель $I_2$)
$ \stackrel{+5}{N} + 1e^- \rightarrow \stackrel{+4}{N} $ | 10 | процесс восстановления (окислитель $HNO_3$)
3. Используем найденные коэффициенты для расстановки в уравнении. Перед $I_2$ ставим 1 (не пишется), перед $HNO_3$ и $NO_2$ — 10, перед $HIO_3$ — 2.
$ I_2 + 10HNO_3 \rightarrow 2HIO_3 + 10NO_2 + H_2O $
4. Уравняем число атомов водорода ($H$) и кислорода ($O$). Слева 10 атомов $H$, справа в $2HIO_3$ 2 атома $H$. Необходимо добавить $10-2=8$ атомов $H$ справа, т.е. 4 молекулы $H_2O$.
$ I_2 + 10HNO_3 \rightarrow 2HIO_3 + 10NO_2 + 4H_2O $
Проверка по кислороду: слева $10 \cdot 3 = 30$ атомов; справа $2 \cdot 3 + 10 \cdot 2 + 4 \cdot 1 = 6 + 20 + 4 = 30$ атомов. Уравнение сбалансировано.
Ответ: $I_2 + 10HNO_3 = 2HIO_3 + 10NO_2 + 4H_2O$. Восстановитель — $I_2$ (процесс окисления), окислитель — $HNO_3$ (за счет $N^{+5}$, процесс восстановления).
P + HNO₃ → H₃PO₄ + NO + H₂O
Решение:
1. Определим степени окисления элементов, которые их изменяют:
$ \stackrel{0}{P} + H\stackrel{+5}{N}O_3 \rightarrow H_3\stackrel{+5}{P}O_4 + \stackrel{+2}{N}O + H_2O $
Фосфор ($P$) повышает степень окисления с 0 до +5.
Азот ($N$) понижает степень окисления с +5 до +2.
2. Составим электронный баланс. Фосфор — восстановитель, азотная кислота — окислитель.
$ \stackrel{0}{P} - 5e^- \rightarrow \stackrel{+5}{P} $ | 3 | процесс окисления (восстановитель $P$)
$ \stackrel{+5}{N} + 3e^- \rightarrow \stackrel{+2}{N} $ | 5 | процесс восстановления (окислитель $HNO_3$)
3. Расставим коэффициенты: 3 перед $P$ и $H_3PO_4$, 5 перед $HNO_3$ и $NO$.
$ 3P + 5HNO_3 \rightarrow 3H_3PO_4 + 5NO $
4. Уравняем водород и кислород. В данном случае вода является реагентом. Справа $3 \cdot 3 = 9$ атомов $H$, слева в $5HNO_3$ 5 атомов $H$. Необходимо добавить $9-5=4$ атома $H$ слева, т.е. 2 молекулы $H_2O$.
$ 3P + 5HNO_3 + 2H_2O \rightarrow 3H_3PO_4 + 5NO $
Проверка по кислороду: слева $5 \cdot 3 + 2 \cdot 1 = 15 + 2 = 17$ атомов; справа $3 \cdot 4 + 5 \cdot 1 = 12 + 5 = 17$ атомов. Уравнение сбалансировано.
Ответ: $3P + 5HNO_3 + 2H_2O = 3H_3PO_4 + 5NO$. Восстановитель — $P$ (процесс окисления), окислитель — $HNO_3$ (за счет $N^{+5}$, процесс восстановления).
FeS₂ + HNO₃ → Fe(NO₃)₃ + H₂SO₄ + NO₂ + H₂O
Решение:
1. Определим степени окисления. В пирите ($FeS_2$) железо имеет с.о. +2, а сера -1.
$ \stackrel{+2}{Fe}\stackrel{-1}{S_2} + H\stackrel{+5}{N}O_3 \rightarrow \stackrel{+3}{Fe}(NO_3)_3 + H_2\stackrel{+6}{S}O_4 + \stackrel{+4}{N}O_2 + H_2O $
Железо ($Fe$) повышает степень окисления с +2 до +3. Сера ($S$) повышает степень окисления с -1 до +6. Азот ($N$) понижает степень окисления с +5 до +4.
2. Составим электронный баланс. Пирит $FeS_2$ — восстановитель, азотная кислота — окислитель.
$ \stackrel{+2}{Fe}\stackrel{-1}{S_2} - 15e^- \rightarrow \stackrel{+3}{Fe} + 2\stackrel{+6}{S} $ (железо отдает 1 электрон, два атома серы отдают $2 \cdot 7=14$ электронов, итого 15) | 1 | процесс окисления (восстановитель $FeS_2$)
$ \stackrel{+5}{N} + 1e^- \rightarrow \stackrel{+4}{N} $ | 15 | процесс восстановления (окислитель $HNO_3$)
3. Расставим коэффициенты. Ставим 1 перед $FeS_2$ и $Fe(NO_3)_3$, 2 перед $H_2SO_4$ (т.к. в $FeS_2$ 2 атома серы), 15 перед $NO_2$.
$ FeS_2 + HNO_3 \rightarrow Fe(NO_3)_3 + 2H_2SO_4 + 15NO_2 + H_2O $
4. Считаем атомы азота справа: 3 в $Fe(NO_3)_3$ и 15 в $15NO_2$, итого 18. Значит, перед $HNO_3$ ставим коэффициент 18.
$ FeS_2 + 18HNO_3 \rightarrow Fe(NO_3)_3 + 2H_2SO_4 + 15NO_2 + H_2O $
5. Уравняем водород. Слева 18 атомов $H$. Справа 4 в $2H_2SO_4$. Нужно добавить $18-4=14$ атомов $H$, т.е. 7 молекул $H_2O$.
$ FeS_2 + 18HNO_3 \rightarrow Fe(NO_3)_3 + 2H_2SO_4 + 15NO_2 + 7H_2O $
Проверка по кислороду: слева $18 \cdot 3 = 54$; справа $3 \cdot 3 + 2 \cdot 4 + 15 \cdot 2 + 7 \cdot 1 = 9 + 8 + 30 + 7 = 54$. Уравнение сбалансировано.
Ответ: $FeS_2 + 18HNO_3 = Fe(NO_3)_3 + 2H_2SO_4 + 15NO_2 + 7H_2O$. Восстановитель — $FeS_2$ (процесс окисления), окислитель — $HNO_3$ (за счет $N^{+5}$, процесс восстановления).
Zn + HNO₃ → Zn(NO₃)₂ + NH₄NO₃ + H₂O
Решение:
1. Определим степени окисления. В нитрате аммония $NH_4NO_3$ азот находится в двух степенях окисления: -3 в ионе аммония ($NH_4^+$) и +5 в нитрат-ионе ($NO_3^-$).
$ \stackrel{0}{Zn} + H\stackrel{+5}{N}O_3 \rightarrow \stackrel{+2}{Zn}(NO_3)_2 + \stackrel{-3}{N}H_4\stackrel{+5}{N}O_3 + H_2O $
Цинк ($Zn$) повышает степень окисления с 0 до +2. Азот ($N$) из азотной кислоты понижает степень окисления с +5 до -3.
2. Составим электронный баланс. Цинк — восстановитель, азотная кислота — окислитель.
$ \stackrel{0}{Zn} - 2e^- \rightarrow \stackrel{+2}{Zn} $ | 4 | процесс окисления (восстановитель $Zn$)
$ \stackrel{+5}{N} + 8e^- \rightarrow \stackrel{-3}{N} $ | 1 | процесс восстановления (окислитель $HNO_3$)
3. Расставим коэффициенты. Ставим 4 перед $Zn$ и $Zn(NO_3)_2$, 1 перед $NH_4NO_3$.
$ 4Zn + HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + H_2O $
4. Считаем атомы азота справа: в $4Zn(NO_3)_2$ их $4 \cdot 2 = 8$, в $NH_4NO_3$ их 2, итого 10. Ставим коэффициент 10 перед $HNO_3$.
$ 4Zn + 10HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + H_2O $
5. Уравняем водород. Слева 10 атомов $H$. Справа 4 в $NH_4NO_3$. Нужно добавить $10-4=6$ атомов $H$, т.е. 3 молекулы $H_2O$.
$ 4Zn + 10HNO_3 \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O $
Проверка по кислороду: слева $10 \cdot 3 = 30$; справа $4 \cdot (2 \cdot 3) + 3 + 3 \cdot 1 = 24 + 3 + 3 = 30$. Уравнение сбалансировано.
Ответ: $4Zn + 10HNO_3 = 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O$. Восстановитель — $Zn$ (процесс окисления), окислитель — $HNO_3$ (за счет $N^{+5}$, процесс восстановления).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-46 расположенного на странице 92 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-46 (с. 92), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















