Вариант 2, страница 96 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. Контрольная работа по теме «Строение атома. Химическая связь. Окислительно-восстановительные реакции» - страница 96.
Вариант 2 (с. 96)
Условие. Вариант 2 (с. 96)
скриншот условия

Вариант 2
1. Дайте краткую характеристику элемента фосфора.
Положение в периодической системе; электронная конфигурация атомов; валентные возможности; возможные степени окисления (с примерами веществ); высший оксид, его характер; высший гидроксид, его характер; водородное соединение.
2. Даны следующие вещества: хлор, хлорид калия, хлороводород. Напишите формулы этих веществ и определите тип химической связи. Покажите направление смещения электронной плотности, если она смещена; ответ мотивируйте. Составьте электронные формулы для данных веществ.
3. Закончите уравнения реакций, составьте схемы электронного баланса и расставьте коэффициенты в уравнениях:
$Al + Cl_2 = ...$
$Li + H_2 = ...$
$H_2 + Fe_2O_3 = ...$
4. Преобразуйте данные схемы в уравнения реакций, составьте схемы электронного баланса:
$NH_3 + O_2 \to NO + H_2O$
$Zn + H_2SO_4$ (конц.) $\to ZnSO_4 + H_2S\uparrow + H_2O$
Решение. Вариант 2 (с. 96)
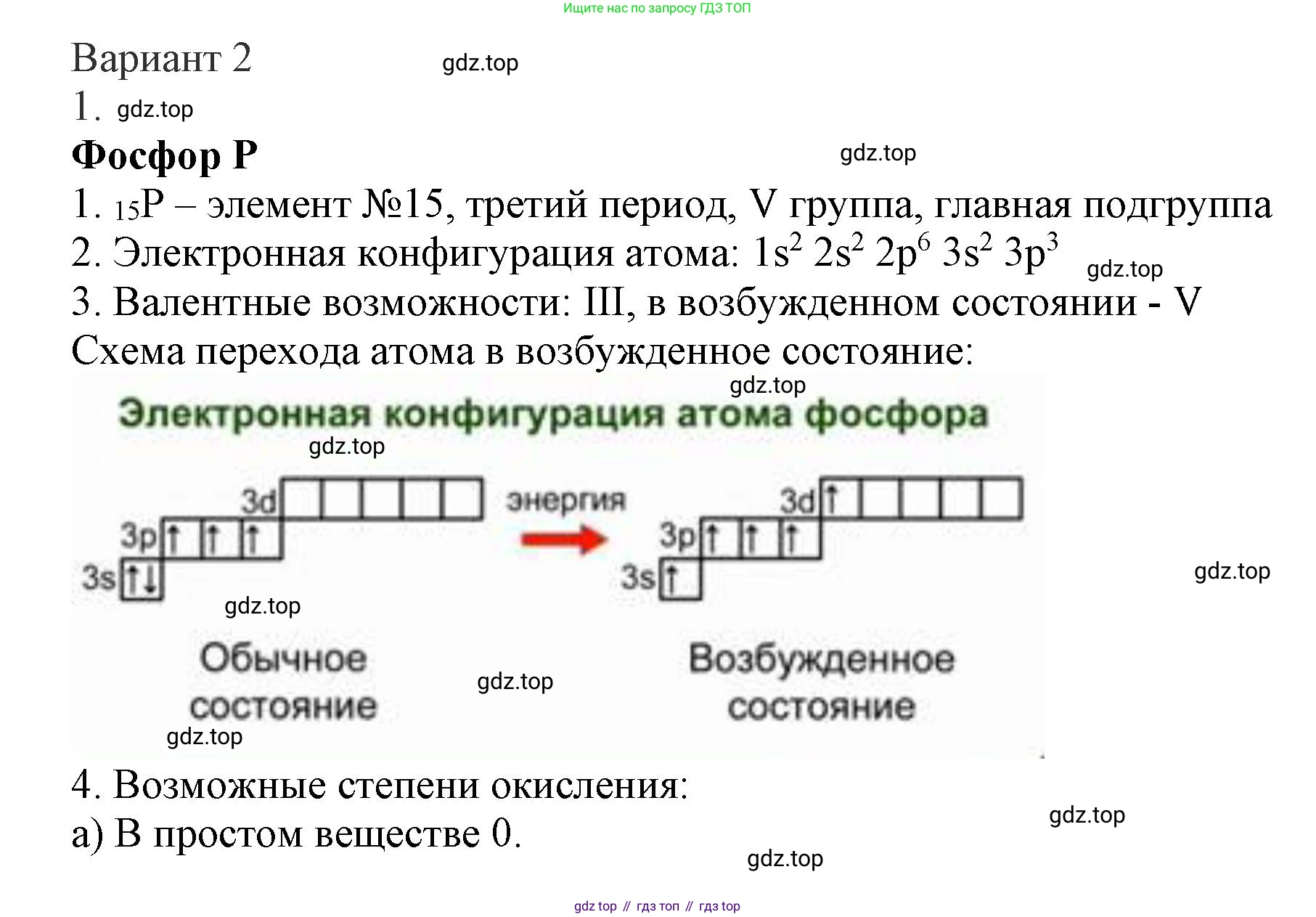


Решение 2. Вариант 2 (с. 96)
1. Дайте краткую характеристику элемента фосфора.
Положение в периодической системе: Фосфор (P) — химический элемент с атомным номером 15. Расположен в 3-м периоде, V группе, главной подгруппе (15-я группа) Периодической системы химических элементов Д.И. Менделеева. Является неметаллом.
Электронная конфигурация атомов: Атом фосфора содержит 15 электронов. Электронная конфигурация: $1s^22s^22p^63s^23p^3$. На внешнем энергетическом уровне (валентном) находится 5 электронов ($3s^23p^3$), что определяет его принадлежность к V группе.
Валентные возможности: В основном состоянии атом фосфора имеет три неспаренных электрона на 3p-подуровне, что обуславливает его валентность III. При переходе в возбужденное состояние один электрон с 3s-подуровня может переместиться на свободную 3d-орбиталь, в результате чего у атома становится пять неспаренных электронов ($3s^13p^33d^1$). Это объясняет возможность проявления валентности V.
Возможные степени окисления:
• -3 (в соединениях с металлами и водородом, например, фосфид кальция $Ca_3P_2$, фосфин $PH_3$);
• 0 (в простом веществе, например, белый фосфор $P_4$);
• +1 (например, в фосфорноватистой кислоте $H_3PO_2$);
• +3 (например, в оксиде фосфора(III) $P_2O_3$, хлориде фосфора(III) $PCl_3$);
• +5 (высшая, например, в оксиде фосфора(V) $P_2O_5$, ортофосфорной кислоте $H_3PO_4$).
Высший оксид, его характер: Высший оксид фосфора — оксид фосфора(V), формула $P_2O_5$ (чаще существует в виде димера $P_4O_{10}$). Это типичный кислотный оксид, который бурно реагирует с водой, образуя кислоты, и с основаниями, образуя соли (фосфаты).
Высший гидроксид, его характер: Высшему оксиду фосфора соответствует ортофосфорная кислота $H_3PO_4$. Это трехосновная кислота средней силы, проявляющая все типичные свойства кислот.
Водородное соединение: Летучее водородное соединение фосфора — фосфин ($PH_3$). Это ядовитый газ с неприятным запахом, проявляет слабые основные свойства.
Ответ: Фосфор (P) — элемент 15-й группы, 3-го периода, p-элемент. Электронная конфигурация валентного слоя $3s^23p^3$. Проявляет валентности III и V и степени окисления от -3 до +5. Высший оксид $P_2O_5$ — кислотный. Высший гидроксид $H_3PO_4$ — трехосновная кислота. Водородное соединение — $PH_3$ (фосфин).
2. Даны следующие вещества: хлор, хлорид калия, хлороводород. Напишите формулы этих веществ и определите тип химической связи. Покажите направление смещения электронной плотности, если она смещена; ответ мотивируйте. Составьте электронные формулы для данных веществ.
Хлор
• Формула: $Cl_2$.
• Тип химической связи: ковалентная неполярная. Связь образована двумя одинаковыми атомами неметалла (хлор). Их электроотрицательности равны, поэтому смещения электронной плотности не происходит.
• Направление смещения электронной плотности: отсутствует.
• Электронная формула (структура Льюиса): $: \ddot{Cl} : \ddot{Cl} :$
Хлорид калия
• Формула: $KCl$.
• Тип химической связи: ионная. Связь образована атомом типичного металла (калий, K) и атомом типичного неметалла (хлор, Cl). Разница в их электроотрицательностях очень велика (ЭО(Cl) = 3,16; ЭО(K) = 0,82), что приводит к переходу электрона от калия к хлору и образованию ионов $K^+$ и $Cl^-$.
• Направление смещения электронной плотности: происходит полный перенос электрона от атома калия к атому хлора.
• Электронная формула: $[K]^+ [: \ddot{Cl} :]^-$
Хлороводород
• Формула: $HCl$.
• Тип химической связи: ковалентная полярная. Связь образована двумя разными атомами неметаллов (водород и хлор) с разной электроотрицательностью (ЭО(H) = 2,20; ЭО(Cl) = 3,16).
• Направление смещения электронной плотности: общая электронная пара смещена в сторону более электроотрицательного атома хлора. На атоме хлора возникает частичный отрицательный заряд ($ \delta- $), а на атоме водорода — частичный положительный заряд ($ \delta+ $). Направление смещения: $H^{\delta+} \rightarrow Cl^{\delta-}$.
• Электронная формула: $H : \ddot{Cl} :$
Ответ:
1. Хлор ($Cl_2$): ковалентная неполярная связь, смещение плотности отсутствует, электронная формула $: \ddot{Cl} : \ddot{Cl} :$.
2. Хлорид калия ($KCl$): ионная связь, электрон переходит от K к Cl, электронная формула $[K]^+ [: \ddot{Cl} :]^-$.
3. Хлороводород ($HCl$): ковалентная полярная связь, электронная плотность смещена к атому хлора ($H \rightarrow Cl$), электронная формула $H : \ddot{Cl} :$.
3. Закончите уравнения реакций, составьте схемы электронного баланса и расставьте коэффициенты в уравнениях:
a) $Al + Cl_2 = ...$
Уравнение реакции: $2Al + 3Cl_2 \rightarrow 2AlCl_3$.
Схема электронного баланса:
$Al^0 - 3e^- \rightarrow Al^{+3}$ | 2 (окисление, восстановитель)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 3 (восстановление, окислитель)
Ответ: $2Al + 3Cl_2 = 2AlCl_3$.
б) $Li + H_2 = ...$
Уравнение реакции: $2Li + H_2 \rightarrow 2LiH$.
Схема электронного баланса:
$Li^0 - 1e^- \rightarrow Li^{+1}$ | 2 (окисление, восстановитель)
$H_2^0 + 2e^- \rightarrow 2H^{-1}$ | 1 (восстановление, окислитель)
Ответ: $2Li + H_2 = 2LiH$.
в) $H_2 + Fe_2O_3 = ...$
Уравнение реакции: $3H_2 + Fe_2O_3 \rightarrow 2Fe + 3H_2O$.
Схема электронного баланса:
$H_2^0 - 2e^- \rightarrow 2H^{+1}$ | 3 (окисление, восстановитель)
$2Fe^{+3} + 6e^- \rightarrow 2Fe^0$ | 1 (восстановление, окислитель)
Ответ: $3H_2 + Fe_2O_3 = 2Fe + 3H_2O$.
4. Преобразуйте данные схемы в уравнения реакций, составьте схемы электронного баланса:
a) $NH_3 + O_2 \rightarrow NO + H_2O$
Схема электронного баланса:
$N^{-3} - 5e^- \rightarrow N^{+2}$ | 4 (окисление, восстановитель)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 5 (восстановление, окислитель)
Ответ: $4NH_3 + 5O_2 = 4NO + 6H_2O$.
б) $Zn + H_2SO_4 (конц.) \rightarrow ZnSO_4 + H_2S\uparrow + H_2O$
Схема электронного баланса:
$Zn^0 - 2e^- \rightarrow Zn^{+2}$ | 4 (окисление, восстановитель)
$S^{+6} + 8e^- \rightarrow S^{-2}$ (в $H_2S$) | 1 (восстановление, окислитель)
Коэффициенты расставляются с учетом того, что часть серной кислоты идет на образование соли $ZnSO_4$. Всего требуется $1+4=5$ молекул $H_2SO_4$.
Ответ: $4Zn + 5H_2SO_4 (конц.) = 4ZnSO_4 + H_2S\uparrow + 4H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения Вариант 2 расположенного на странице 96 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 2 (с. 96), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















