Номер 7-45, страница 92 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.3. Окислительно-восстановительные реакции - номер 7-45, страница 92.
№7-45 (с. 92)
Условие. №7-45 (с. 92)
скриншот условия

7-45. К схемам реакций, приведенным в задаче 7-43, составьте электронный баланс, указав окислитель и восстановитель, окисление и восстановление. Расставьте коэффициенты.
Решение. №7-45 (с. 92)
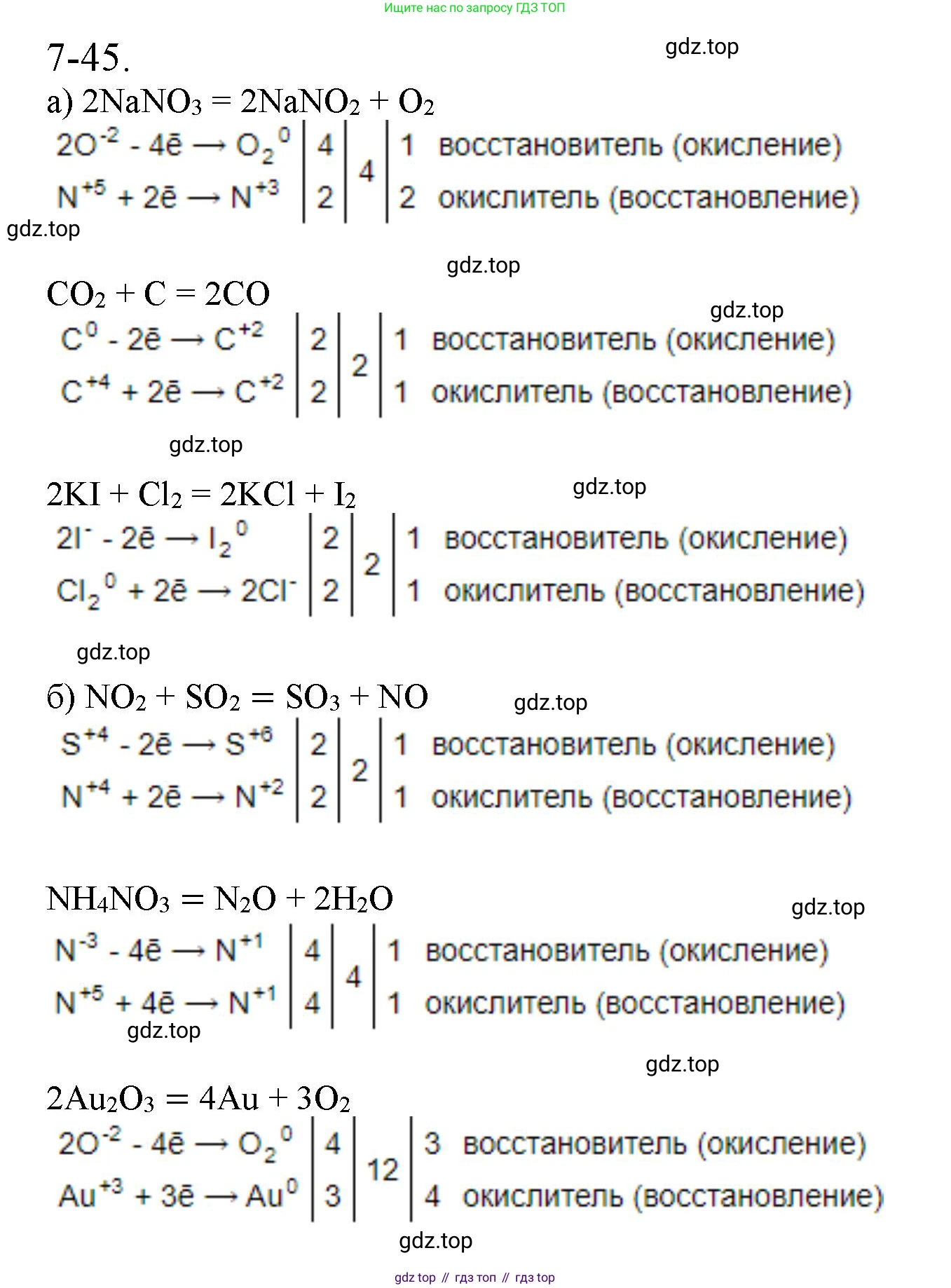
Решение 2. №7-45 (с. 92)
Поскольку в задании требуется обратиться к схемам реакций из задачи 7-43, которая не предоставлена, для решения будут использованы типичные окислительно-восстановительные реакции, часто встречающиеся в учебных пособиях.
а) $P + CuO \rightarrow Cu + P_{2}O_{5}$1. Определим степени окисления элементов до и после реакции:
$ \overset{0}{P} + \overset{+2}{Cu}\overset{-2}{O} \rightarrow \overset{0}{Cu} + \overset{+5}{P}_{2}\overset{-2}{O}_{5} $
2. Составим полуреакции окисления и восстановления, чтобы найти коэффициенты методом электронного баланса.
Фосфор ($P$) изменяет степень окисления с 0 до +5. Он отдает электроны, то есть окисляется. Это процесс окисления, а $P$ — восстановитель.
$ P^{0} - 5e^{-} \rightarrow P^{+5} $
Медь ($Cu$) изменяет степень окисления с +2 до 0. Она принимает электроны, то есть восстанавливается. Это процесс восстановления, а $Cu^{+2}$ (в составе $CuO$) — окислитель.
$ Cu^{+2} + 2e^{-} \rightarrow Cu^{0} $
3. Находим наименьшее общее кратное для числа отданных и принятых электронов (5 и 2), оно равно 10. Делим 10 на число электронов в каждой полуреакции, чтобы найти коэффициенты:
$ \begin{array}{rcl|c|l} P^{0} - 5e^{-} & \rightarrow & P^{+5} & 2 & \text{окисление (восстановитель)} \\ Cu^{+2} + 2e^{-} & \rightarrow & Cu^{0} & 5 & \text{восстановление (окислитель)} \end{array} $
4. Расставляем полученные коэффициенты в схеме реакции. Коэффициент 2 ставим перед веществами, содержащими фосфор, и 5 — перед веществами, содержащими медь. Учитывая, что в продуктах фосфор находится в виде $P_{2}O_{5}$, для балансировки атомов фосфора перед простым веществом $P$ ставим коэффициент 2, а перед $P_{2}O_{5}$ — 1.
$ 2P + 5CuO \rightarrow 5Cu + P_{2}O_{5} $
5. Проверяем баланс атомов кислорода: слева $5 \times 1 = 5$, справа $1 \times 5 = 5$. Уравнение сбалансировано.
Ответ: $2P + 5CuO \rightarrow 5Cu + P_{2}O_{5}$. Восстановитель — $P$ (процесс окисления), окислитель — $CuO$ (за счет $Cu^{+2}$, процесс восстановления).
б) $KMnO_{4} + HCl \rightarrow MnCl_{2} + Cl_{2} + KCl + H_{2}O$1. Определим степени окисления элементов, которые их изменяют:
$ K\overset{+7}{Mn}O_{4} + H\overset{-1}{Cl} \rightarrow \overset{+2}{Mn}Cl_{2} + \overset{0}{Cl}_{2} + KCl + H_{2}O $
2. Составим полуреакции. Марганец ($Mn$) изменяет степень окисления с +7 до +2, принимая 5 электронов. Он восстанавливается, значит $KMnO_{4}$ (за счет $Mn^{+7}$) — окислитель.
$ Mn^{+7} + 5e^{-} \rightarrow Mn^{+2} $
Хлор ($Cl$) изменяет степень окисления с -1 до 0, отдавая 1 электрон. Он окисляется, значит $HCl$ (за счет $Cl^{-1}$) — восстановитель. Так как в продуктах образуется молекула $Cl_{2}$, в полуреакции нужно учесть 2 атома хлора.
$ 2Cl^{-1} - 2e^{-} \rightarrow Cl_{2}^{0} $
3. Составим электронный баланс. Наименьшее общее кратное для 5 и 2 равно 10.
$ \begin{array}{rcl|c|l} Mn^{+7} + 5e^{-} & \rightarrow & Mn^{+2} & 2 & \text{восстановление (окислитель)} \\ 2Cl^{-1} - 2e^{-} & \rightarrow & Cl_{2}^{0} & 5 & \text{окисление (восстановитель)} \end{array} $
4. Расставляем коэффициенты. Перед соединениями марганца ($KMnO_{4}$ и $MnCl_{2}$) ставим 2. Перед $Cl_{2}$ ставим 5.
$ 2KMnO_{4} + HCl \rightarrow 2MnCl_{2} + 5Cl_{2} + KCl + H_{2}O $
5. Уравниваем остальные элементы. Слева 2 атома калия ($K$), значит, перед $KCl$ справа ставим 2.
$ 2KMnO_{4} + HCl \rightarrow 2MnCl_{2} + 5Cl_{2} + 2KCl + H_{2}O $
Теперь считаем хлор справа: $2 \times 2$ в $MnCl_{2}$ + $5 \times 2$ в $Cl_{2}$ + $2 \times 1$ в $KCl$ = $4 + 10 + 2 = 16$ атомов. Значит, перед $HCl$ слева ставим 16.
$ 2KMnO_{4} + 16HCl \rightarrow 2MnCl_{2} + 5Cl_{2} + 2KCl + H_{2}O $
Слева 16 атомов водорода ($H$), значит, перед $H_{2}O$ справа ставим 8 ($8 \times 2 = 16$).
$ 2KMnO_{4} + 16HCl \rightarrow 2MnCl_{2} + 5Cl_{2} + 2KCl + 8H_{2}O $
6. Проверяем баланс по кислороду: слева $2 \times 4 = 8$, справа $8 \times 1 = 8$. Уравнение сбалансировано.
Ответ: $2KMnO_{4} + 16HCl \rightarrow 2MnCl_{2} + 5Cl_{2} + 2KCl + 8H_{2}O$. Восстановитель — $HCl$ (за счет $Cl^{-1}$, процесс окисления), окислитель — $KMnO_{4}$ (за счет $Mn^{+7}$, процесс восстановления).
в) $FeS_{2} + O_{2} \rightarrow Fe_{2}O_{3} + SO_{2}$1. Определим степени окисления. Пирит $FeS_{2}$ является дисульфидом железа(II), где у железа степень окисления +2, а у серы -1 ($Fe^{+2}(S^{-1})_{2}$).
$ \overset{+2}{Fe}\overset{-1}{S}_{2} + \overset{0}{O}_{2} \rightarrow \overset{+3}{Fe}_{2}O_{3} + \overset{+4}{S}O_{2} $
2. В этой реакции окисляются и железо, и сера, входящие в состав $FeS_{2}$. Кислород восстанавливается. Следовательно, $FeS_{2}$ — восстановитель, $O_{2}$ — окислитель.
Процесс окисления (для одной формульной единицы $FeS_{2}$):
$ Fe^{+2} \rightarrow Fe^{+3} + 1e^{-} $
$ 2S^{-1} \rightarrow 2S^{+4} + 10e^{-} $ (каждый атом серы отдает 5 электронов)
Суммарно $FeS_{2}$ отдает $1 + 10 = 11$ электронов.
Процесс восстановления:
$ O_{2}^{0} + 4e^{-} \rightarrow 2O^{-2} $
3. Составим электронный баланс. Наименьшее общее кратное для 11 и 4 равно 44.
$ \begin{array}{rcl|c|l} FeS_{2} - 11e^{-} & \rightarrow & Fe^{+3} + 2S^{+4} & 4 & \text{окисление (восстановитель)} \\ O_{2}^{0} + 4e^{-} & \rightarrow & 2O^{-2} & 11 & \text{восстановление (окислитель)} \end{array} $
4. Расставляем коэффициенты. Перед $FeS_{2}$ ставим 4, перед $O_{2}$ — 11.
$ 4FeS_{2} + 11O_{2} \rightarrow Fe_{2}O_{3} + SO_{2} $
5. Уравниваем продукты. Слева 4 атома железа ($Fe$), значит, перед $Fe_{2}O_{3}$ ставим 2.
$ 4FeS_{2} + 11O_{2} \rightarrow 2Fe_{2}O_{3} + SO_{2} $
Слева $4 \times 2 = 8$ атомов серы ($S$), значит, перед $SO_{2}$ ставим 8.
$ 4FeS_{2} + 11O_{2} \rightarrow 2Fe_{2}O_{3} + 8SO_{2} $
6. Проверяем баланс по кислороду: слева $11 \times 2 = 22$. Справа $2 \times 3$ (в $Fe_{2}O_{3}$) + $8 \times 2$ (в $SO_{2}$) = $6 + 16 = 22$. Уравнение сбалансировано.
Ответ: $4FeS_{2} + 11O_{2} \rightarrow 2Fe_{2}O_{3} + 8SO_{2}$. Восстановитель — $FeS_{2}$ (процесс окисления), окислитель — $O_{2}$ (процесс восстановления).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-45 расположенного на странице 92 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-45 (с. 92), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















