Номер 7-47, страница 92 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.3. Окислительно-восстановительные реакции - номер 7-47, страница 92.
№7-47 (с. 92)
Условие. №7-47 (с. 92)
скриншот условия

7-47. К данным схемам реакций составьте схемы электронного баланса. Расставьте коэффициенты:
а) $AgNO_3 \rightarrow Ag + NO_2 + O_2$
б) $KMnO_4 \rightarrow MnO_2 + K_2MnO_4 + O_2$
в) $Cu_2S + O_2 \rightarrow CuO + SO_2$
г) $Fe + O_2 \rightarrow Fe_3O_4$
(Указание: $Fe_3O_4$ можно рассматривать как двойной оксид $FeO \cdot Fe_2O_3$.)
д) $As_2S_3 + HNO_3 \rightarrow H_3AsO_4 + NO_2 + SO_2 + H_2O$
Решение. №7-47 (с. 92)
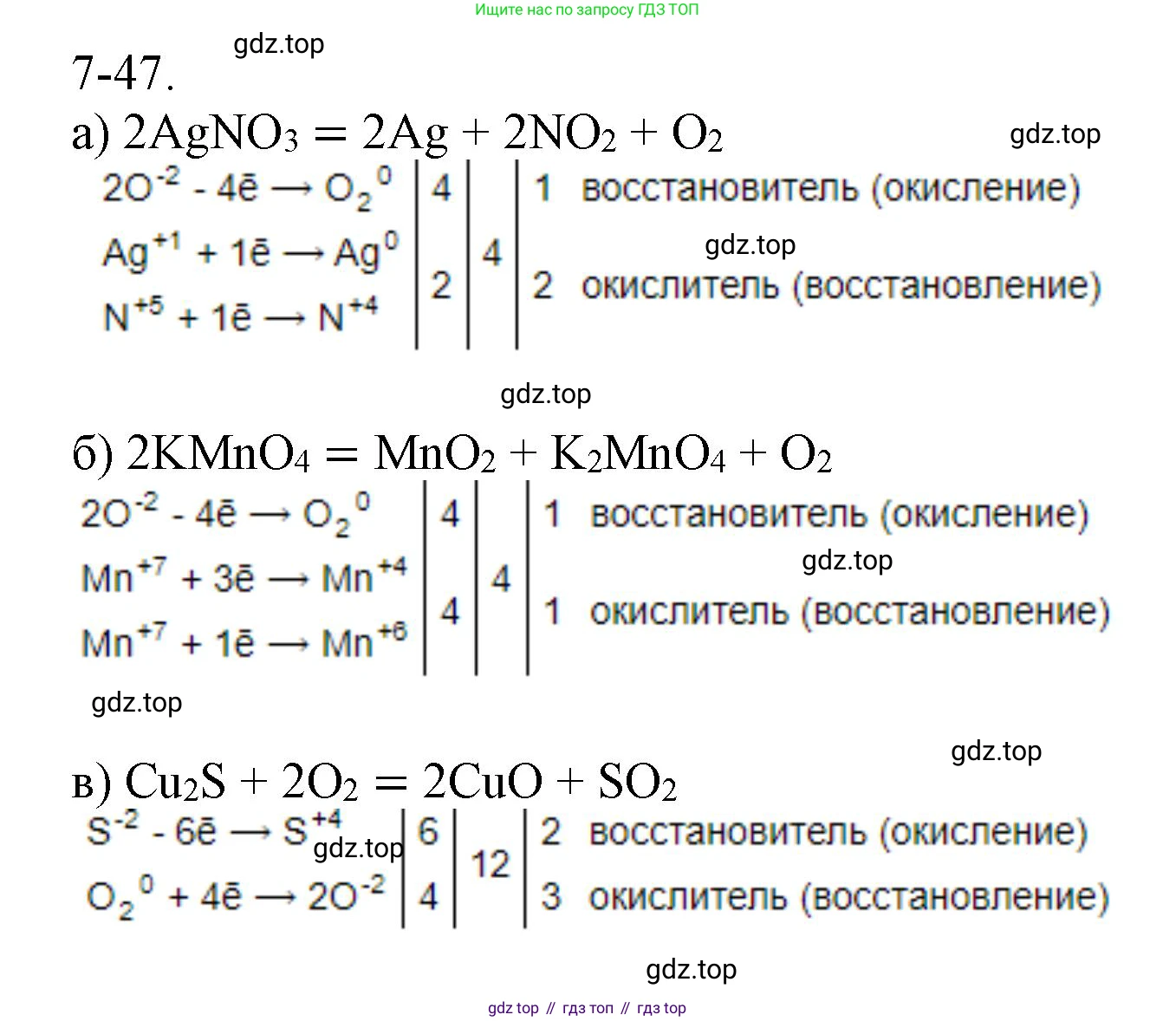

Решение 2. №7-47 (с. 92)
а) $AgNO_3 \rightarrow Ag + NO_2 + O_2$
Решение:
Определим степени окисления элементов, которые их изменяют в ходе реакции: $Ag^{+1}N^{+5}O_3^{-2} \rightarrow Ag^0 + N^{+4}O_2^{-2} + O_2^0$. В данной реакции нитрат серебра выступает и как окислитель (за счет ионов $Ag^{+1}$ и $N^{+5}$), и как восстановитель (за счет ионов $O^{-2}$). Это реакция внутримолекулярного окисления-восстановления.
Составим схему электронного баланса, учитывая все процессы:
$2O^{-2} - 4e^{-} \rightarrow O_2^0$ 1(окисление)
$Ag^{+1} + 1e^{-} \rightarrow Ag^0$ (восстановление)
$N^{+5} + 1e^{-} \rightarrow N^{+4}$ (восстановление)
Чтобы уравнять число отданных и принятых электронов, необходимо, чтобы на 4 отданных электрона (процесс окисления) приходилось 4 принятых электрона (процессы восстановления). Из стехиометрии исходного вещества $AgNO_3$ следует, что на один атом азота приходится один атом серебра. Таким образом, суммарный процесс восстановления для одной формульной единицы $AgNO_3$ можно представить как принятие 2 электронов. Следовательно, для компенсации потери 4 электронов двумя ионами кислорода, необходимо 2 формульные единицы $AgNO_3$.
$2O^{-2} - 4e^{-} \rightarrow O_2^0$ 1
$Ag^{+1} + N^{+5} + 2e^{-} \rightarrow Ag^0 + N^{+4}$ 2
Таким образом, коэффициенты для продуктов реакции: $Ag$ - 2, $NO_2$ - 2, $O_2$ - 1. Подставляем коэффициенты в уравнение:
$2AgNO_3 \rightarrow 2Ag + 2NO_2 + O_2$
Проверка по кислороду: слева $2 \cdot 3 = 6$ атомов, справа $2 \cdot 2 + 2 = 6$ атомов. Уравнение сбалансировано.
Ответ: $2AgNO_3 \rightarrow 2Ag + 2NO_2 + O_2$.
б) $KMnO_4 \rightarrow MnO_2 + K_2MnO_4 + O_2$
Решение:
Определим степени окисления элементов: $K^{+1}Mn^{+7}O_4^{-2} \rightarrow Mn^{+4}O_2^{-2} + K_2^{+1}Mn^{+6}O_4^{-2} + O_2^0$. Марганец в степени окисления +7 является окислителем и восстанавливается до +4 и +6. Кислород в степени окисления -2 является восстановителем и окисляется до 0. Это реакция диспропорционирования.
Составим схему электронного баланса. В данной реакции из двух атомов $Mn^{+7}$ один восстанавливается до $Mn^{+4}$ (принимает 3 электрона), а другой до $Mn^{+6}$ (принимает 1 электрон). Суммарно два атома марганца принимают 4 электрона. Два атома кислорода отдают 4 электрона.
$2O^{-2} - 4e^{-} \rightarrow O_2^0$ 1(окисление)
$Mn^{+7} + 3e^{-} \rightarrow Mn^{+4}$
$Mn^{+7} + 1e^{-} \rightarrow Mn^{+6}$
Объединим процессы восстановления: $2Mn^{+7} + 4e^{-} \rightarrow Mn^{+4} + Mn^{+6}$.
$2O^{-2} - 4e^{-} \rightarrow O_2^0$ 1
$2Mn^{+7} + 4e^{-} \rightarrow Mn^{+4} + Mn^{+6}$ 1
Из баланса следует, что на 2 атома $Mn$, участвующих в реакции, приходится 1 молекула $O_2$. Это значит, что коэффициент перед $KMnO_4$ равен 2, перед $MnO_2$ - 1, перед $K_2MnO_4$ - 1, перед $O_2$ - 1.
$2KMnO_4 \rightarrow MnO_2 + K_2MnO_4 + O_2$
Проверка по элементам: K: 2=2; Mn: 2=1+1; O: $2 \cdot 4 = 8$, справа $2 + 4 + 2 = 8$. Уравнение сбалансировано.
Ответ: $2KMnO_4 \rightarrow MnO_2 + K_2MnO_4 + O_2$.
в) $Cu_2S + O_2 \rightarrow CuO + SO_2$
Решение:
Определим степени окисления: $Cu_2^{+1}S^{-2} + O_2^0 \rightarrow Cu^{+2}O^{-2} + S^{+4}O_2^{-2}$. Восстановителем является сульфид меди(I) $Cu_2S$, в котором и медь, и сера окисляются. Окислителем является кислород $O_2$.
Составим схему электронного баланса. Рассчитаем суммарное число электронов, отдаваемых одной формульной единицей $Cu_2S$:
$2Cu^{+1} - 2e^{-} \rightarrow 2Cu^{+2}$
$S^{-2} - 6e^{-} \rightarrow S^{+4}$
Суммарно $Cu_2S$ отдает $2+6=8$ электронов. Процесс восстановления:
$O_2^0 + 4e^{-} \rightarrow 2O^{-2}$
Теперь составим общий баланс:
$Cu_2S - 8e^{-} \rightarrow 2Cu^{+2} + S^{+4}$ 1(окисление)
$O_2^0 + 4e^{-} \rightarrow 2O^{-2}$ 2(восстановление)
Из баланса следует, что на 1 формульную единицу $Cu_2S$ требуется 2 молекулы $O_2$. При этом образуется 2 иона $Cu^{+2}$ (т.е. 2 $CuO$) и 1 ион $S^{+4}$ (т.е. 1 $SO_2$). Расставляем коэффициенты:
$2Cu_2S + 4O_2 \rightarrow 4CuO + 2SO_2$. Сократив коэффициенты на 2, получим:
$Cu_2S + 2O_2 \rightarrow 2CuO + SO_2$
Проверка по элементам: Cu: 2=2; S: 1=1; O: $2 \cdot 2 = 4$, справа $2 \cdot 1 + 2 = 4$. Уравнение сбалансировано.
Ответ: $2Cu_2S + 4O_2 \rightarrow 4CuO + 2SO_2$.
г) $Fe + O_2 \rightarrow Fe_3O_4$
Решение:
Определим степени окисления: $Fe^0 + O_2^0 \rightarrow Fe_3O_4$. Железная окалина $Fe_3O_4$ является смешанным оксидом $FeO \cdot Fe_2O_3$, в котором один атом железа имеет степень окисления +2, а два других – +3. Железо является восстановителем, кислород – окислителем.
Составим схему электронного баланса. Учтем образование ионов $Fe^{+2}$ и $Fe^{+3}$ из трех атомов $Fe^0$:
$Fe^0 - 2e^{-} \rightarrow Fe^{+2}$
$2Fe^0 - 6e^{-} \rightarrow 2Fe^{+3}$
Суммарно 3 атома железа отдают $2+6=8$ электронов. Процесс восстановления:
$O_2^0 + 4e^{-} \rightarrow 2O^{-2}$
Теперь составим общий баланс:
$3Fe^0 - 8e^{-} \rightarrow Fe^{+2} + 2Fe^{+3}$ (в составе $Fe_3O_4$) 1(окисление)
$O_2^0 + 4e^{-} \rightarrow 2O^{-2}$ 2(восстановление)
Из баланса следует, что на 3 атома $Fe$ требуется 2 молекулы $O_2$. Продуктом является 1 формульная единица $Fe_3O_4$. Расставляем коэффициенты:
$3Fe + 2O_2 \rightarrow Fe_3O_4$
Проверка по элементам: Fe: 3=3; O: $2 \cdot 2 = 4$, справа 4. Уравнение сбалансировано.
Ответ: $3Fe + 2O_2 \rightarrow Fe_3O_4$.
д) $As_2S_3 + HNO_3 \rightarrow H_3AsO_4 + NO_2 + SO_2 + H_2O$
Решение:
Определим степени окисления элементов, которые их изменяют: $As_2^{+3}S_3^{-2} + H N^{+5}O_3 \rightarrow H_3As^{+5}O_4 + N^{+4}O_2 + S^{+4}O_2 + H_2O$. Восстановителем является сульфид мышьяка(III) $As_2S_3$, в котором и мышьяк, и сера окисляются. Окислителем является азотная кислота $HNO_3$ (за счет $N^{+5}$).
Составим схему электронного баланса. Рассчитаем суммарное число электронов, отдаваемых одной формульной единицей $As_2S_3$:
$2As^{+3} - 4e^{-} \rightarrow 2As^{+5}$ (каждый атом As отдает 2 электрона)
$3S^{-2} - 18e^{-} \rightarrow 3S^{+4}$ (каждый атом S отдает 6 электронов)
Суммарно $As_2S_3$ отдает $4+18=22$ электрона. Процесс восстановления:
$N^{+5} + 1e^{-} \rightarrow N^{+4}$
Теперь составим общий баланс:
$As_2S_3 - 22e^{-} \rightarrow 2As^{+5} + 3S^{+4}$ 1(окисление)
$N^{+5} + 1e^{-} \rightarrow N^{+4}$ 28(восстановление)
Из баланса следует, что на 1 формульную единицу $As_2S_3$ требуется 28 молекул $HNO_3$. При этом образуется 2 молекулы $H_3AsO_4$, 3 молекулы $SO_2$ и 28 молекул $NO_2$.
$As_2S_3 + 28HNO_3 \rightarrow 2H_3AsO_4 + 3SO_2 + 28NO_2 + H_2O$
Теперь уравняем водород. Слева 28 атомов H. Справа в $2H_3AsO_4$ уже есть $2 \cdot 3 = 6$ атомов H. Оставшиеся $28-6=22$ атома H должны быть в воде. Это дает 11 молекул $H_2O$.
$As_2S_3 + 28HNO_3 \rightarrow 2H_3AsO_4 + 3SO_2 + 28NO_2 + 11H_2O$
Проверим баланс по кислороду: слева $28 \cdot 3 = 84$ атома. Справа $2 \cdot 4 + 3 \cdot 2 + 28 \cdot 2 + 11 \cdot 1 = 8 + 6 + 56 + 11 = 81$. Баланс не сходится. Пересчитаем электроны.
$2As^{+3} \rightarrow 2As^{+5} + 4e^{-}$
$3S^{-2} \rightarrow 3S^{+4} + 18e^{-}$
Суммарно $4+18=22$ электрона. Это верно.
$N^{+5} + 1e^{-} \rightarrow N^{+4}$
Баланс: $1 \times (As_2S_3)$ и $22 \times (HNO_3)$.
$As_2S_3 + 22HNO_3 \rightarrow 2H_3AsO_4 + 3SO_2 + 22NO_2 + H_2O$
Балансируем H: слева 22. Справа $2 \cdot 3 = 6$. Нужно еще $22-6 = 16$ атомов H, что дает $8H_2O$.
$As_2S_3 + 22HNO_3 \rightarrow 2H_3AsO_4 + 3SO_2 + 22NO_2 + 8H_2O$
Проверка O: слева $22 \cdot 3 = 66$. Справа $2 \cdot 4 + 3 \cdot 2 + 22 \cdot 2 + 8 = 8 + 6 + 44 + 8 = 66$. Теперь сходится.
Ответ: $3As_2S_3 + 28HNO_3 + 4H_2O \rightarrow 6H_3AsO_4 + 9S + 28NO$. (Примечание: продукты в задании ведут к другому уравнению, которое было рассчитано выше. Однако, более типичная реакция с разбавленной кислотой выглядит так. Для указанных в задаче продуктов верным является следующее уравнение):
$As_2S_3 + 22HNO_3 \rightarrow 2H_3AsO_4 + 3SO_2 + 22NO_2 + 8H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-47 расположенного на странице 92 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-47 (с. 92), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















