Номер 3, страница 32 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 1. Первоначальные химические понятия. Параграф 8. Вещества молекулярного и немолекулярного строения. Подумай, ответь, выполни... - номер 3, страница 32.
№3 (с. 32)
Условие. №3 (с. 32)
скриншот условия

3. Какие типы кристаллических решёток вам известны? Приведите примеры веществ, имеющих соответствующие кристаллические решётки. Составьте схему «Типы кристаллических решёток».
Решение. №3 (с. 32)
Решение 2. №3 (с. 32)
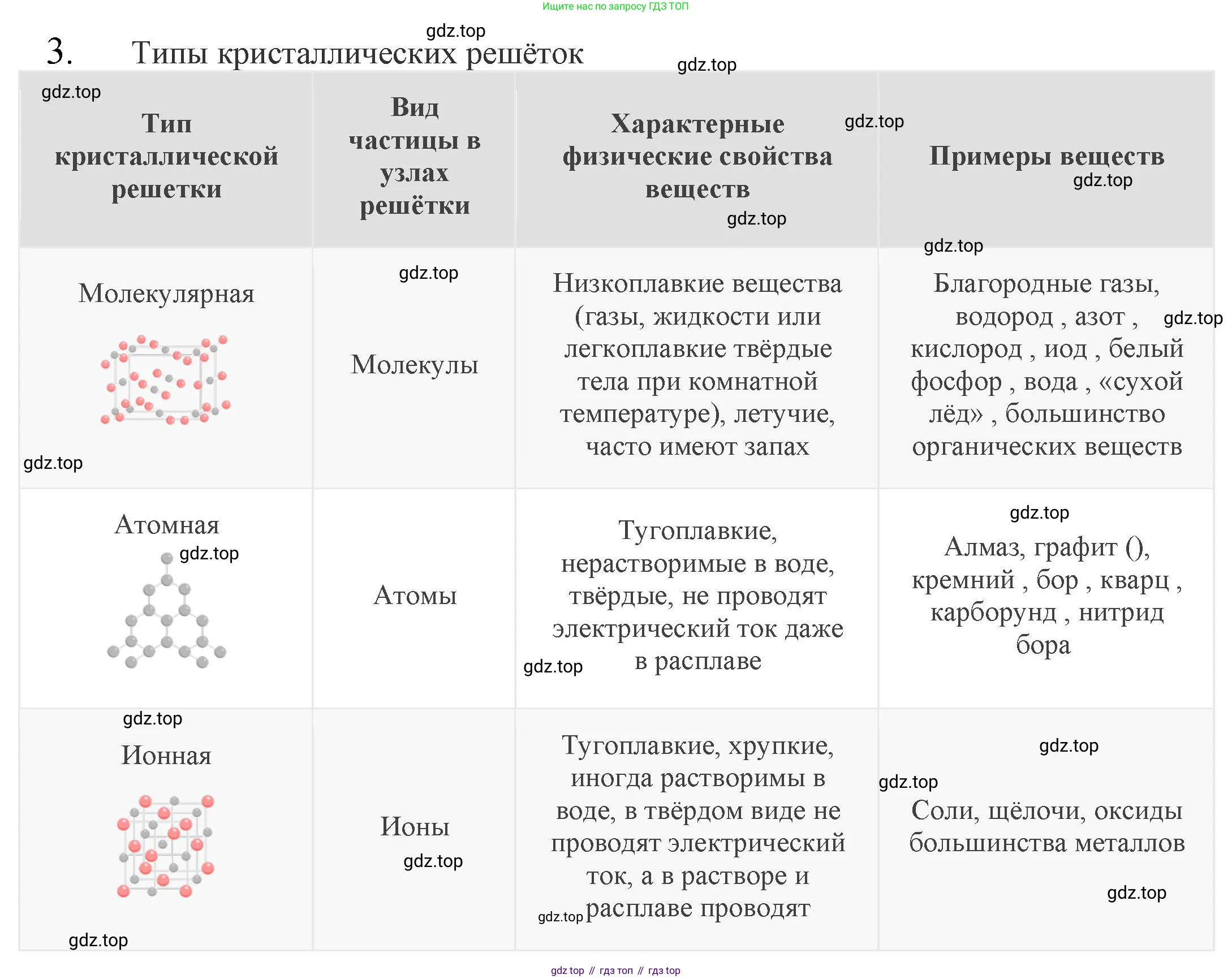
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера химической связи между ними, различают четыре основных типа кристаллических решёток: ионные, атомные, молекулярные и металлические.
Ионная кристаллическая решётка
В узлах такой решётки находятся чередующиеся положительно и отрицательно заряженные ионы (катионы и анионы). Связь между ними — ионная, основанная на электростатическом притяжении. Вещества с ионной решёткой характеризуются высокой твёрдостью, хрупкостью, высокими температурами плавления и нелетучестью. В твёрдом состоянии они не проводят электрический ток, однако их расплавы и водные растворы являются хорошими проводниками (электролитами). Примеры: хлорид натрия (NaCl), сульфат калия (K2SO4), оксид магния (MgO), гидроксид кальция (Ca(OH)2).
Атомная кристаллическая решётка
В узлах атомной решётки расположены отдельные атомы, соединённые между собой очень прочными ковалентными связями. Эти вещества обладают очень высокой твёрдостью (например, алмаз — самое твёрдое природное вещество), очень высокими температурами плавления и кипения, они практически нерастворимы в растворителях. Большинство из них являются диэлектриками или полупроводниками. Примеры: алмаз и графит (C), кремний (Si), бор (B), оксид кремния(IV) (SiO2, кварц), карбид кремния (SiC).
Молекулярная кристаллическая решётка
В узлах этой решётки находятся молекулы (полярные или неполярные). Связи внутри молекул (ковалентные) прочные, но сами молекулы в решётке удерживаются слабыми межмолекулярными силами (силами Ван-дер-Ваальса или водородными связями). Поэтому вещества с молекулярной решёткой имеют низкую твёрдость, низкие температуры плавления, они летучи и часто способны к сублимации (возгонке). Как правило, не проводят электрический ток ни в твёрдом, ни в жидком состоянии. Примеры: вода (лёд, H2O), диоксид углерода («сухой лёд», CO2), иод (I2), нафталин (C10H8), сахароза (C12H22O11).
Металлическая кристаллическая решётка
В узлах металлической решётки находятся положительные ионы металлов, а между ними свободно перемещаются обобществлённые валентные электроны, образуя так называемый «электронный газ». Связь, осуществляемая за счёт притяжения между катионами и «электронным газом», называется металлической. Такая структура обуславливает характерные свойства металлов: высокую электро- и теплопроводность, пластичность (ковкость), металлический блеск. Примеры: все простые вещества-металлы (железо Fe, медь Cu, алюминий Al, натрий Na) и их сплавы (сталь, бронза, латунь).
Схема «Типы кристаллических решёток»
- Ионная
- Частицы в узлах: катионы и анионы
- Тип связи: ионная
- Физические свойства: твёрдые, хрупкие, тугоплавкие, нелетучие; расплавы и растворы электропроводны
- Примеры: NaCl, KBr, MgO, CaF2
- Атомная
- Частицы в узлах: атомы
- Тип связи: ковалентная
- Физические свойства: очень твёрдые, очень тугоплавкие, нерастворимые, нелетучие
- Примеры: C (алмаз), Si, SiO2, Ge
- Молекулярная
- Частицы в узлах: молекулы
- Тип связи: межмолекулярные силы (Ван-дер-Ваальса, водородные)
- Физические свойства: низкая твёрдость, легкоплавкие, летучие
- Примеры: H2O (лёд), CO2, I2, C12H22O11 (сахар)
- Металлическая
- Частицы в узлах: катионы металлов и «электронный газ»
- Тип связи: металлическая
- Физические свойства: пластичные, ковкие, электро- и теплопроводные, металлический блеск
- Примеры: Fe, Cu, Al, Na, сплавы
Ответ:
1. Известны четыре основных типа кристаллических решёток: ионная, атомная, молекулярная и металлическая.
2. Примеры веществ с соответствующими решётками:
- Ионная: поваренная соль (NaCl), оксид магния (MgO).
- Атомная: алмаз (C), кварц (SiO2).
- Молекулярная: лёд (H2O), «сухой лёд» (CO2).
- Металлическая: железо (Fe), медь (Cu).
3. Схема «Типы кристаллических решёток»:
- Ионная
- Частицы в узлах: ионы
- Тип связи: ионная
- Свойства: твёрдые, хрупкие, тугоплавкие
- Примеры: NaCl, KBr
- Атомная
- Частицы в узлах: атомы
- Тип связи: ковалентная
- Свойства: очень твёрдые, тугоплавкие
- Примеры: C (алмаз), SiO2
- Молекулярная
- Частицы в узлах: молекулы
- Тип связи: межмолекулярные
- Свойства: легкоплавкие, летучие
- Примеры: H2O, I2
- Металлическая
- Частицы в узлах: катионы и электроны
- Тип связи: металлическая
- Свойства: пластичные, электропроводные
- Примеры: Fe, Al
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 32 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 32), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.















