Номер 4, страница 87 - гдз по химии 8 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: синий, зелёный
ISBN: 978-5-09-105831-4
Популярные ГДЗ в 8 классе
Глава II. Кислород. Горение. Параграф 24. Применение кислорода. Круговорот кислорода в природе. Подумай, ответь, выполни - номер 4, страница 87.
№4 (с. 87)
Условие 2023. №4 (с. 87)
скриншот условия

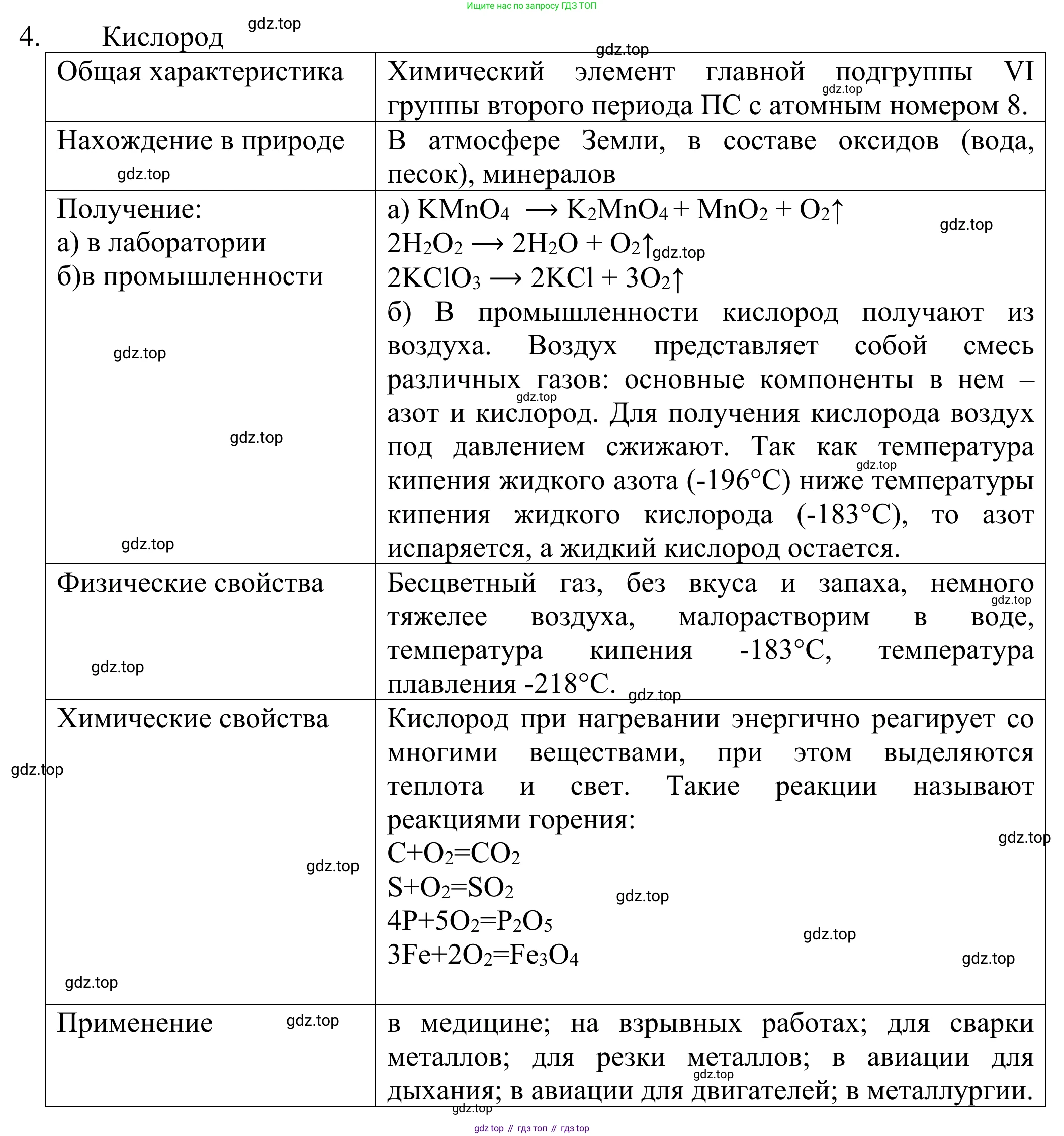
4. Обобщите знания о кислороде по плану, который представлен в таблице. Данную таблицу подготовьте с помощью компьютера и заполните её. Проверьте заполненную таблицу у соседа по парте.
Кислород
Общая характеристика
Нахождение в природе
Получение:
а) в лаборатории
б) в промышленности
Физические свойства
Химические свойства
Применение
Решение 2023. №4 (с. 87)
Решение 2. №4 (с. 87)
Общая характеристика
Кислород — это химический элемент с символом $O$, расположенный в 16-й группе (старая классификация — VIА), 2-м периоде периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Является неметаллом из группы халькогенов. Относительная атомная масса элемента кислорода составляет $A_r(O) \approx 15,999$ а.е.м. Электронная конфигурация атома: $1s^22s^22p^4$. Как простое вещество кислород существует в виде двух аллотропных модификаций: кислорода ($O_2$) и озона ($O_3$). Молекула кислорода $O_2$ состоит из двух атомов, её относительная молекулярная масса равна 32. Кислород — самый распространенный химический элемент в земной коре. Ответ: Кислород ($O$) — химический элемент №8, неметалл 16-й группы. В виде простого вещества ($O_2$) является газом.
Нахождение в природе
Кислород является самым распространенным элементом на Земле, его содержание в земной коре составляет около 47% по массе. В атмосфере он находится в свободном состоянии в виде газа $O_2$, составляя примерно 21% от объема воздуха, а также в виде озона $O_3$ в стратосфере (озоновый слой). Кислород — основная составная часть воды ($H_2O$), на долю которой приходится около 89% массы гидросферы. Он входит в состав огромного количества минералов (например, силикатов, карбонатов, оксидов) и всех важнейших для жизни органических соединений (белков, жиров, углеводов). Ответ: Содержится в атмосфере (21% $O_2$), гидросфере (в составе воды), литосфере (в составе минералов) и биосфере (в составе органических веществ).
Получение:
а) в лаборатории
В лабораторных условиях кислород получают методами, основанными на разложении кислородсодержащих соединений при нагревании или под действием катализаторов. Наиболее распространенные способы:
1. Разложение перманганата калия («марганцовки») при нагревании: $2KMnO_4 \xrightarrow{t^\circ} K_2MnO_4 + MnO_2 + O_2\uparrow$.
2. Каталитическое разложение пероксида водорода ($H_2O_2$) с использованием оксида марганца(IV) $MnO_2$ в качестве катализатора: $2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow$.
3. Термическое разложение хлората калия ($KClO_3$, бертолетова соль), также в присутствии катализатора $MnO_2$: $2KClO_3 \xrightarrow{t^\circ, MnO_2} 2KCl + 3O_2\uparrow$.
Ответ: В лаборатории кислород получают разложением перманганата калия, пероксида водорода или хлората калия.
б) в промышленности
В промышленных масштабах кислород получают в основном из атмосферного воздуха. Главный метод — фракционная перегонка (ректификация) жидкого воздуха. Для этого воздух сначала сжижают путем сильного охлаждения и сжатия. Затем жидкий воздух постепенно нагревают. Так как температура кипения азота ($-196^\circ C$) ниже, чем у кислорода ($-183^\circ C$), азот испаряется первым, а оставшаяся жидкость обогащается кислородом. Реже, для получения особо чистого кислорода, применяют метод электролиза воды: $2H_2O \xrightarrow{электролиз} 2H_2\uparrow + O_2\uparrow$. Ответ: Основной промышленный способ — перегонка сжиженного воздуха; реже — электролиз воды.
Физические свойства
При нормальных условиях кислород ($O_2$) — это газ, не имеющий цвета, вкуса и запаха. Он немного тяжелее воздуха: молярная масса кислорода 32 г/моль, а средняя молярная масса воздуха — около 29 г/моль. Кислород плохо растворяется в воде. При температуре $-183^\circ C$ (90 К) кислород конденсируется в жидкость голубого цвета. При переходе в твердое состояние при температуре $-218,8^\circ C$ (54 К) образует кристаллы светло-синего цвета. Ответ: Газ без цвета и запаха, тяжелее воздуха, малорастворим в воде. Температура кипения $-183^\circ C$.
Химические свойства
Кислород является химически активным неметаллом и сильным окислителем. Он вступает в реакции со многими простыми и сложными веществами, которые часто сопровождаются выделением тепла и света (горение).
1. Взаимодействие с металлами с образованием оксидов (или пероксидов): $4Li + O_2 \rightarrow 2Li_2O$.
2. Взаимодействие с неметаллами: $C + O_2 \xrightarrow{t^\circ} CO_2$.
3. Окисление сложных веществ (горение): $CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O$.
Кислород активно поддерживает процессы горения и необходим для дыхания подавляющего большинства живых организмов на Земле. Ответ: Сильный окислитель, реагирует с большинством элементов, образуя оксиды, и со сложными веществами в реакциях горения; поддерживает дыхание.
Применение
Широкое применение кислорода обусловлено его способностью поддерживать горение и дыхание.
В металлургии: для ускорения процесса выплавки стали в конвертерах и мартеновских печах, а также для газопламенной резки и сварки металлов.
В медицине: для обогащения дыхательных смесей при нарушении функции дыхания, в кислородных палатках, подушках, для проведения анестезии.
В химической промышленности: как окислитель при синтезе многих важных соединений, например, азотной кислоты, серной кислоты, оксида этилена.
В авиации и космонавтике: жидкий кислород используется в качестве окислителя в ракетных двигателях.
В жизнеобеспечении: в дыхательных аппаратах для работы в безвоздушном пространстве (космонавты, водолазы) или на подводных лодках. Ответ: Применяется в металлургии, медицине, химической промышленности, в качестве ракетного окислителя и в системах жизнеобеспечения.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 87 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 87), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.
















