Номер 5, страница 106 - гдз по химии 8 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: синий, зелёный
ISBN: 978-5-09-105831-4
Популярные ГДЗ в 8 классе
Глава III. Водород. Параграф 29. Свойства и применение водорода. Подумай, ответь, выполни - номер 5, страница 106.
№5 (с. 106)
Условие 2023. №5 (с. 106)
скриншот условия

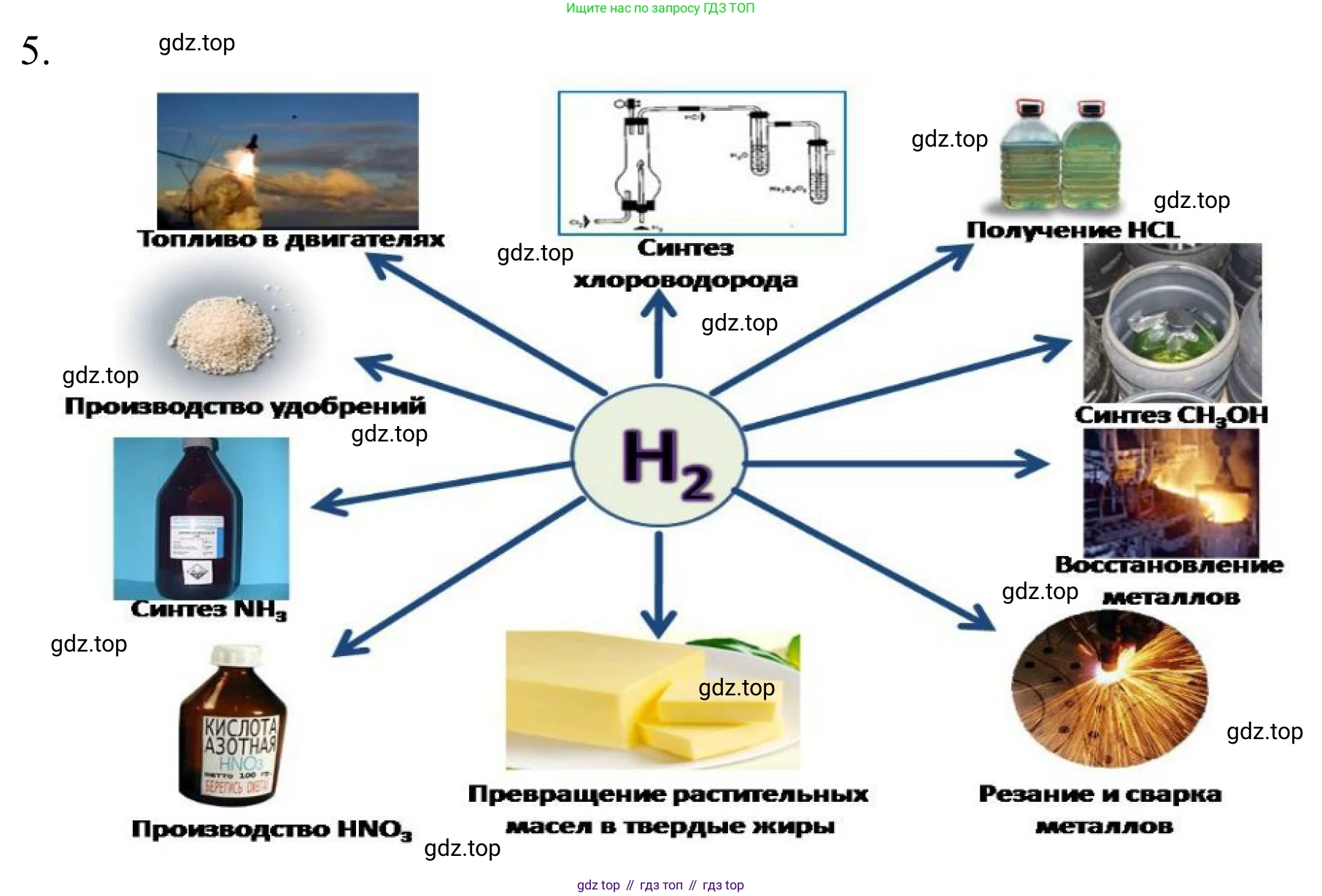
5. Используя дополнительные источники информации, подготовьте инфографику «Роль водорода в живых системах и технике».
Решение 2023. №5 (с. 106)

Решение 2. №5 (с. 106)
Роль водорода в живых системах
Водород — самый распространенный элемент во Вселенной и ключевой компонент всех живых организмов. Хотя его массовая доля в организме человека составляет около 10%, по количеству атомов он занимает первое место (более 60%). Его роль многогранна и фундаментальна.
- Составная часть воды: Жизнь на Земле невозможна без воды ($H_2O$), которая составляет 70–80% массы клетки. Водород, входя в состав молекулы воды, обеспечивает ее уникальные свойства: полярность, способность быть универсальным растворителем для биохимических реакций, участие в терморегуляции.
- Структурный элемент органических молекул: Водород является неотъемлемой частью всех классов органических соединений, лежащих в основе жизни:
- Белки (состоят из аминокислот);
- Жиры (липиды);
- Углеводы (например, глюкоза $C_6H_{12}O_6$);
- Нуклеиновые кислоты (ДНК и РНК).
- Образование водородных связей: Это слабые связи, возникающие между атомом водорода одной молекулы и электроотрицательным атомом (O, N) другой. Несмотря на свою слабость, они играют критическую роль:
- Поддержание вторичной и третичной структуры белков, что определяет их ферментативную и структурную функции.
- Соединение двух цепей ДНК в двойную спираль, обеспечивая стабильность хранения генетической информации.
- Определение физических свойств воды (высокая температура кипения, теплоемкость).
- Участие в энергетическом обмене: Водород в форме протонов ($H^+$) и электронов ($e^-$) является центральным звеном клеточного дыхания. В митохондриях перенос электронов и протонов водорода по дыхательной цепи приводит к созданию протонного градиента, энергия которого используется для синтеза АТФ — универсальной энергетической "валюты" клетки.
- Регуляция кислотно-щелочного баланса (pH): Концентрация ионов водорода ($H^+$) определяет pH биологических жидкостей. Поддержание строго определенного уровня pH является жизненно важным условием для нормальной работы ферментов и протекания биохимических процессов.
Ответ: В живых системах водород является основополагающим элементом: он входит в состав воды и всех органических молекул, с помощью водородных связей стабилизирует структуру ДНК и белков, участвует в производстве клеточной энергии (АТФ) и в поддержании кислотно-щелочного равновесия.
Роль водорода в технике
Водород — это универсальный и перспективный элемент для промышленности и технологий, от химического синтеза до энергетики будущего.
- Химическая промышленность: Водород является важнейшим сырьем для производства:
- Аммиака ($NH_3$): В процессе Габера-Боша ($N_2 + 3H_2 \rightleftharpoons 2NH_3$) из водорода и азота получают аммиак, который служит основой для производства азотных удобрений, необходимых для обеспечения продовольственной безопасности в мире.
- Метанола ($CH_3OH$): Синтез метанола из оксида углерода и водорода ($CO + 2H_2 \to CH_3OH$). Метанол используется как растворитель и сырье для получения других органических веществ.
- Гидрогенизация: Процесс присоединения водорода используется в нефтепереработке (гидрокрекинг, гидроочистка для удаления серы из топлива) и в пищевой промышленности (превращение жидких растительных масел в твердые жиры, например, маргарин).
- Энергетика: Водород рассматривается как один из самых чистых и эффективных энергоносителей.
- Ракетное топливо: Жидкий водород в паре с жидким кислородом — одно из самых эффективных ракетных топлив, обеспечивающее высокую удельную тягу.
- Топливные элементы: Устройства, которые преобразуют химическую энергию водорода и кислорода непосредственно в электричество с выделением только воды ($2H_2 + O_2 \to 2H_2O + \text{энергия}$). Они применяются в автомобилях, автобусах и стационарных электростанциях.
- Экологически чистое топливо: Водород может сжигаться в двигателях внутреннего сгорания, при этом продуктом сгорания является в основном водяной пар.
- Металлургия и обработка материалов:
- Восстановитель: Водород используется для восстановления оксидов металлов до чистых металлов (например, при производстве вольфрама и молибдена).
- Сварка: В кислородно-водородных горелках достигается температура до 2800 °C, что позволяет резать и сваривать тугоплавкие металлы.
- Защитная среда: При термообработке металлов используется для предотвращения окисления.
- Другие применения:
- Охладитель: Благодаря высокой теплопроводности газообразный водород применяется для охлаждения мощных турбогенераторов на электростанциях.
- Электроника: Используется в процессах производства полупроводников и микросхем.
Ответ: В технике водород играет роль важнейшего химического сырья (производство аммиака, метанола, гидрогенизация), перспективного экологически чистого энергоносителя (топливные элементы, ракетное топливо), а также применяется в металлургии в качестве восстановителя и в других высокотехнологичных отраслях.
Другие задания:
Используя ресурсы Интернета
стр. 101Вопросы в начале параграфа
стр. 102Лабораторный опыт
стр. 1041
стр. 1062
стр. 1063
стр. 1064
стр. 1065
стр. 1061
стр. 1062
стр. 1063
стр. 106Вопросы в начале параграфа
стр. 107Лабораторный опыт
стр. 1081
стр. 1102
стр. 110к содержанию
список заданийПомогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 5 расположенного на странице 106 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 106), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.
















