Номер 4, страница 210 - гдз по химии 8 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: синий, зелёный
ISBN: 978-5-09-105831-4
Популярные ГДЗ в 8 классе
Глава VIII. Строение вещества. Химическая связь. Параграф 58. Основные виды химической связи. Подумай, ответь, выполни - номер 4, страница 210.
№4 (с. 210)
Условие 2023. №4 (с. 210)
скриншот условия

4. Учитывая значения электроотрицательностей элементов (см. табл. 19), составьте химические формулы и укажите сдвиг общих электронных пар в соединениях:
а) лития с азотом;
б) кислорода с фтором;
в) углерода с серой;
г) углерода с алюминием.
Решение 2023. №4 (с. 210)

Решение 2. №4 (с. 210)
Для решения задачи необходимо сравнить значения электроотрицательности (ЭО) элементов в каждом соединении. Электроотрицательность — это способность атома притягивать к себе электроны от других атомов в химической связи. Общая электронная пара смещается к атому с большей электроотрицательностью, на котором возникает частичный отрицательный заряд ($δ^−$), в то время как на атоме с меньшей ЭО возникает частичный положительный заряд ($δ^+$). Связь между такими атомами является полярной ковалентной. Если разница ЭО очень велика, связь считают ионной.
Значения электроотрицательности по шкале Полинга для данных элементов:
- Литий (Li): 0.98
- Азот (N): 3.04
- Кислород (O): 3.44
- Фтор (F): 3.98
- Углерод (C): 2.55
- Сера (S): 2.58
- Алюминий (Al): 1.61
а) лития с азотом
Литий (Li) — элемент I группы, в соединениях его степень окисления +1. Азот (N) — элемент V группы, в соединениях с металлами его степень окисления −3. Для составления формулы находим наименьшее общее кратное для зарядов ионов: для 1 и 3 это 3. Таким образом, на один атом азота приходится три атома лития. Химическая формула — $Li_3N$ (нитрид лития).
Сравним электроотрицательности: ЭО(Li) = 0.98, ЭО(N) = 3.04. Разница ЭО ($ΔЭО$) составляет $3.04 - 0.98 = 2.06$. Так как разница велика, связь в соединении носит преимущественно ионный характер. Электронная плотность сильно смещена от атомов лития ($Li^+$) к атому азота ($N^{3-}$).
Ответ: Химическая формула — $Li_3N$. Общие электронные пары смещены к атому азота.
б) кислорода с фтором
Фтор (F) — самый электроотрицательный элемент, его степень окисления в соединениях всегда равна −1. Кислород (O) менее электроотрицателен, чем фтор, поэтому он будет проявлять положительную степень окисления, равную его валентности, то есть +2. Химическая формула — $OF_2$ (фторид кислорода).
Сравним электроотрицательности: ЭО(O) = 3.44, ЭО(F) = 3.98. Разница ЭО ($ΔЭО$) составляет $3.98 - 3.44 = 0.54$. Связь является полярной ковалентной. Электронные пары в связях O–F смещены от атома кислорода к более электроотрицательным атомам фтора. На атоме кислорода возникает частичный положительный заряд ($O^{δ+}$), а на атомах фтора — частичные отрицательные заряды ($F^{δ-}$).
Ответ: Химическая формула — $OF_2$. Общие электронные пары смещены от атома кислорода к атомам фтора.
в) углерода с серой
Углерод (C) и сера (S) — неметаллы. В их наиболее распространенном соединении, сероуглероде, углерод проявляет степень окисления +4, а сера −2. Химическая формула — $CS_2$.
Сравним электроотрицательности: ЭО(C) = 2.55, ЭО(S) = 2.58. Значения ЭО очень близки, разница ($ΔЭО$) составляет всего $2.58 - 2.55 = 0.03$. Связь C–S является ковалентной, практически неполярной. Тем не менее, поскольку сера формально немного более электроотрицательна, происходит очень слабое смещение электронной плотности от атома углерода к атомам серы.
Ответ: Химическая формула — $CS_2$. Смещение общих электронных пар крайне незначительно, формально — в сторону атомов серы.
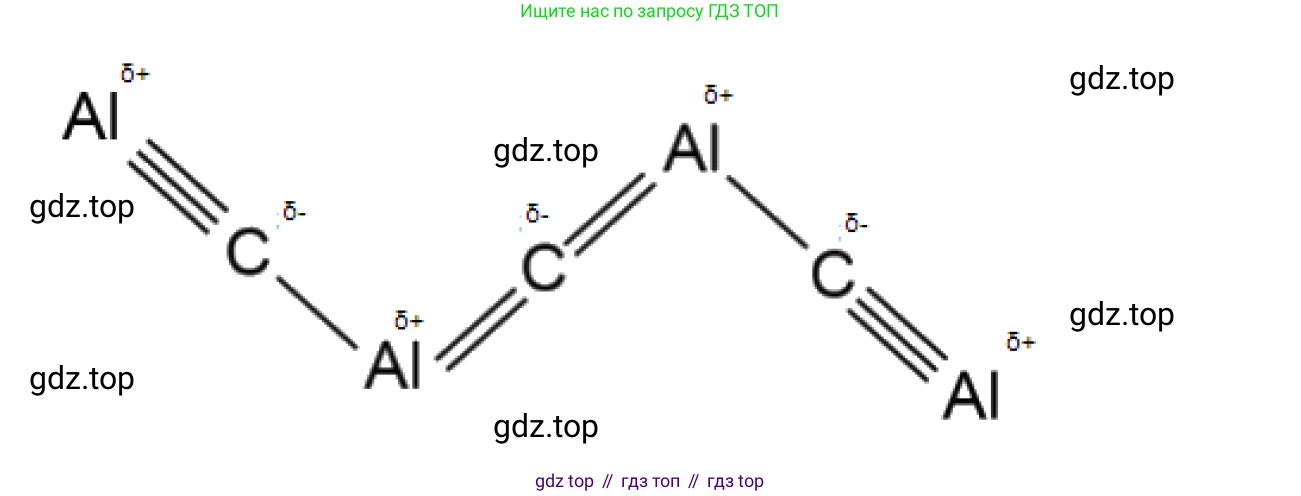
г) углерода с алюминием
Алюминий (Al) — металл III группы, его степень окисления в соединениях +3. Углерод (C), как более электроотрицательный элемент, проявляет в соединении с металлом степень окисления −4. Наименьшее общее кратное для зарядов 3 и 4 равно 12. Таким образом, формула соединения — $Al_4C_3$ (карбид алюминия).
Сравним электроотрицательности: ЭО(Al) = 1.61, ЭО(C) = 2.55. Разница ЭО ($ΔЭО$) составляет $2.55 - 1.61 = 0.94$. Связь является полярной ковалентной. Электронная плотность в связях Al–C смещена от атомов алюминия ($Al^{δ+}$) к более электроотрицательным атомам углерода ($C^{δ-}$).
Ответ: Химическая формула — $Al_4C_3$. Общие электронные пары смещены от атомов алюминия к атомам углерода.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 210 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 210), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.
















