Номер 3, страница 214 - гдз по химии 8 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: синий, зелёный
ISBN: 978-5-09-105831-4
Популярные ГДЗ в 8 классе
Глава VIII. Строение вещества. Химическая связь. Параграф 59. Степень окисления. Подумай, ответь, выполни - номер 3, страница 214.
№3 (с. 214)
Условие 2023. №3 (с. 214)
скриншот условия

3. Составьте уравнения окислительно-восстановительных реакций:
а) алюминия с кислородом;
б) железа с хлором;
в) натрия с серой.
Укажите окислитель и восстановитель.
Решение 2023. №3 (с. 214)
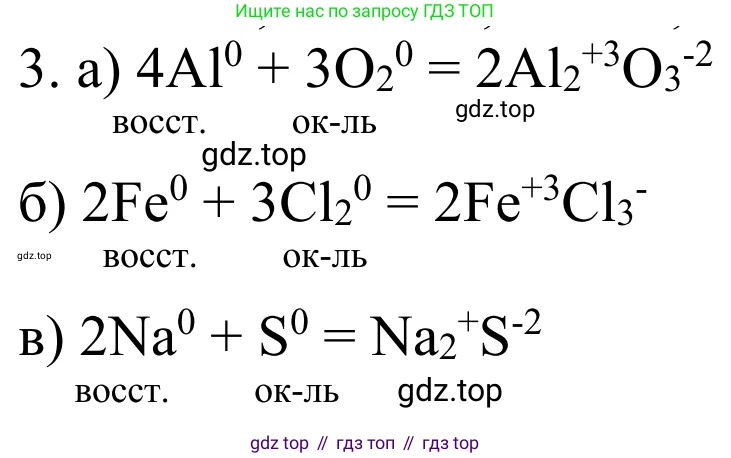
Решение 2. №3 (с. 214)
а) алюминия с кислородом
Решение:
При взаимодействии простого вещества алюминия с простым веществом кислородом образуется оксид алюминия. Это окислительно-восстановительная реакция, в которой алюминий повышает свою степень окисления, а кислород — понижает.
Запишем уравнение реакции, расставив степени окисления у каждого элемента:
$4\overset{0}{Al} + 3\overset{0}{O}_2 \rightarrow 2\overset{+3}{Al}_2\overset{-2}{O}_3$
Составим электронный баланс, чтобы определить окислитель и восстановитель:
$\overset{0}{Al} - 3e^- \rightarrow \overset{+3}{Al}$ | 4 | процесс окисления
$\overset{0}{O}_2 + 4e^- \rightarrow 2\overset{-2}{O}$ | 3 | процесс восстановления
Алюминий ($Al$) отдает электроны, то есть окисляется, и является восстановителем. Кислород ($O_2$) принимает электроны, то есть восстанавливается, и является окислителем.
Ответ: Уравнение реакции: $4Al + 3O_2 = 2Al_2O_3$. Алюминий (Al) — восстановитель, кислород (O₂) — окислитель.
б) железа с хлором
Решение:
При взаимодействии железа с сильным окислителем, таким как хлор, образуется соль — хлорид железа(III). В этой реакции железо отдает электроны, а хлор их принимает.
Запишем уравнение реакции со степенями окисления:
$2\overset{0}{Fe} + 3\overset{0}{Cl}_2 \rightarrow 2\overset{+3}{Fe}\overset{-1}{Cl}_3$
Составим электронный баланс:
$\overset{0}{Fe} - 3e^- \rightarrow \overset{+3}{Fe}$ | 2 | процесс окисления
$\overset{0}{Cl}_2 + 2e^- \rightarrow 2\overset{-1}{Cl}$ | 3 | процесс восстановления
Железо ($Fe$) отдает электроны, повышая степень окисления с 0 до +3. Следовательно, железо — восстановитель. Хлор ($Cl_2$) принимает электроны, понижая степень окисления с 0 до -1, и является окислителем.
Ответ: Уравнение реакции: $2Fe + 3Cl_2 = 2FeCl_3$. Железо (Fe) — восстановитель, хлор (Cl₂) — окислитель.
в) натрия с серой
Решение:
Активный металл натрий реагирует с неметаллом серой при нагревании с образованием соли — сульфида натрия. Это также окислительно-восстановительный процесс.
Запишем уравнение реакции, указав степени окисления:
$2\overset{0}{Na} + \overset{0}{S} \rightarrow \overset{+1}{Na}_2\overset{-2}{S}$
Составим электронный баланс для этой реакции:
$\overset{0}{Na} - 1e^- \rightarrow \overset{+1}{Na}$ | 2 | процесс окисления
$\overset{0}{S} + 2e^- \rightarrow \overset{-2}{S}$ | 1 | процесс восстановления
Натрий ($Na$) отдает электрон, его степень окисления повышается с 0 до +1. Натрий является восстановителем. Сера ($S$) принимает два электрона, ее степень окисления понижается с 0 до -2. Сера является окислителем.
Ответ: Уравнение реакции: $2Na + S = Na_2S$. Натрий (Na) — восстановитель, сера (S) — окислитель.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 214 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 214), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















