Номер 11, страница 72 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2025
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химическая реакция. Параграф 13. Реакции ионного обмена и условия их протекания. Вопросы и задания - номер 11, страница 72.
№11 (с. 72)
Условие. №11 (с. 72)
скриншот условия

11. Используя таблицу растворимости, предложите реактивы для обнаружения следующих ионов:
а) $SO_4^{2-}$;
б) $Cl^{-}$;
в) $S^{2-}$;
г) $Ag^{+}$.
Решение. №11 (с. 72)
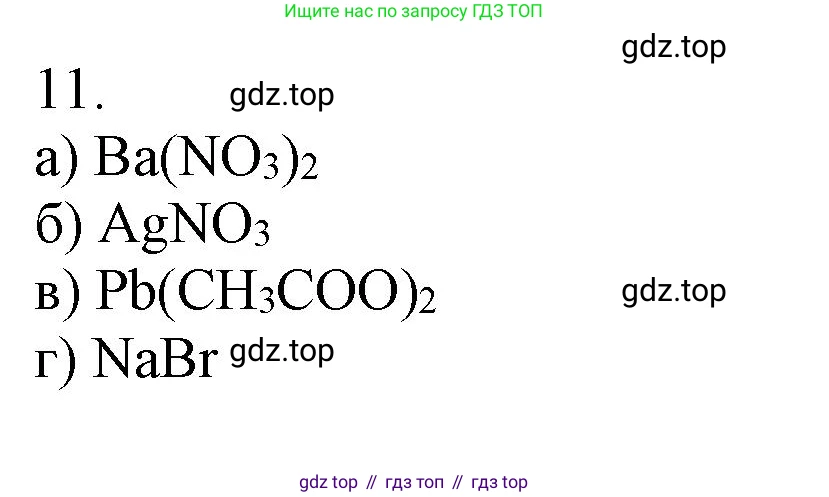
Решение 2. №11 (с. 72)
а) $SO_4^{2-}$
Для обнаружения сульфат-ионов ($SO_4^{2-}$) в растворе используют качественную реакцию с ионами бария ($Ba^{2+}$). В качестве реактива можно использовать любую растворимую соль бария, например, хлорид бария ($BaCl_2$) или нитрат бария ($Ba(NO_3)_2$). При добавлении этого реактива к раствору, содержащему сульфат-ионы, выпадает белый мелкокристаллический осадок сульфата бария ($BaSO_4$). Характерной особенностью этого осадка является то, что он не растворяется в сильных кислотах (например, в $HCl$ или $HNO_3$), что позволяет отличить его от других осадков бария (например, сульфита $BaSO_3$ или фосфата $Ba_3(PO_4)_2$).
Реакция в ионном виде: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4 \downarrow$
Пример реакции в молекулярном виде: $Na_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2NaCl$
Ответ: Растворимые соли бария (например, $BaCl_2$). Признак реакции — выпадение белого осадка, нерастворимого в кислотах.
б) $Cl^-$
Хлорид-ионы ($Cl^-$) обнаруживают с помощью ионов серебра ($Ag^+$). В качестве реактива используют раствор нитрата серебра ($AgNO_3$). При взаимодействии с хлорид-ионами образуется белый творожистый осадок хлорида серебра ($AgCl$). Этот осадок не растворяется в азотной кислоте ($HNO_3$), но хорошо растворяется в водном растворе аммиака ($NH_4OH$) с образованием комплексного соединения.
Реакция в ионном виде: $Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Пример реакции в молекулярном виде: $KCl + AgNO_3 \rightarrow AgCl \downarrow + KNO_3$
Ответ: Раствор нитрата серебра ($AgNO_3$). Признак реакции — выпадение белого творожистого осадка.
в) $S^{2-}$
Для обнаружения сульфид-ионов ($S^{2-}$) можно использовать два основных метода.
1. Осаждение ионами тяжелых металлов. Многие сульфиды металлов нерастворимы и имеют характерную окраску. Например, при добавлении к раствору, содержащему сульфид-ионы, раствора соли свинца(II) (например, нитрата свинца $Pb(NO_3)_2$) выпадает черный осадок сульфида свинца(II) ($PbS$).
Реакция в ионном виде: $Pb^{2+} + S^{2-} \rightarrow PbS \downarrow$
2. Действие сильных кислот. При добавлении к раствору сульфида сильной кислоты (например, соляной $HCl$ или серной $H_2SO_4$) выделяется газ сероводород ($H_2S$), который имеет характерный резкий запах тухлых яиц. Обнаружить газ также можно с помощью смоченной раствором ацетата свинца бумажки, которая почернеет из-за образования $PbS$.
Реакция в ионном виде: $S^{2-} + 2H^+ \rightarrow H_2S \uparrow$
Ответ: Растворимые соли свинца(II) (например, $Pb(NO_3)_2$), признак — черный осадок. Либо сильные кислоты (например, $HCl$), признак — выделение газа с запахом тухлых яиц.
г) $Ag^+$
Ионы серебра ($Ag^+$) являются реактивом на галогенид-ионы, и, в свою очередь, могут быть обнаружены с помощью этих же ионов. Чаще всего для обнаружения ионов серебра используют растворимые хлориды, например, хлорид натрия ($NaCl$) или соляную кислоту ($HCl$). При добавлении раствора хлорида к раствору, содержащему ионы $Ag^+$, выпадает белый творожистый осадок хлорида серебра ($AgCl$), нерастворимый в азотной кислоте.
Реакция в ионном виде: $Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Пример реакции в молекулярном виде: $AgNO_3 + NaCl \rightarrow AgCl \downarrow + NaNO_3$
Ответ: Растворимые хлориды (например, $NaCl$ или $HCl$). Признак реакции — выпадение белого творожистого осадка.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 11 расположенного на странице 72 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №11 (с. 72), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















