Номер 8, страница 72 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химическая реакция. Параграф 13. Реакции ионного обмена и условия их протекания. Вопросы и задания - номер 8, страница 72.
№8 (с. 72)
Условие. №8 (с. 72)
скриншот условия

8. Допишите уравнения реакций:
a) $MgSO_4$ + ... = ...$\downarrow$ + $K_2SO_4$;
б) ... + $HCl$ = ...$\downarrow$ + $HNO_3$;
в) $FeS$ + ... = $FeCl_2$ + ...$\uparrow$;
г) ... + ... = $Fe(OH)_2\downarrow$ + $BaSO_4\downarrow$.
Напишите уравнения этих реакций в полном и сокращённом ионном виде.
Решение. №8 (с. 72)
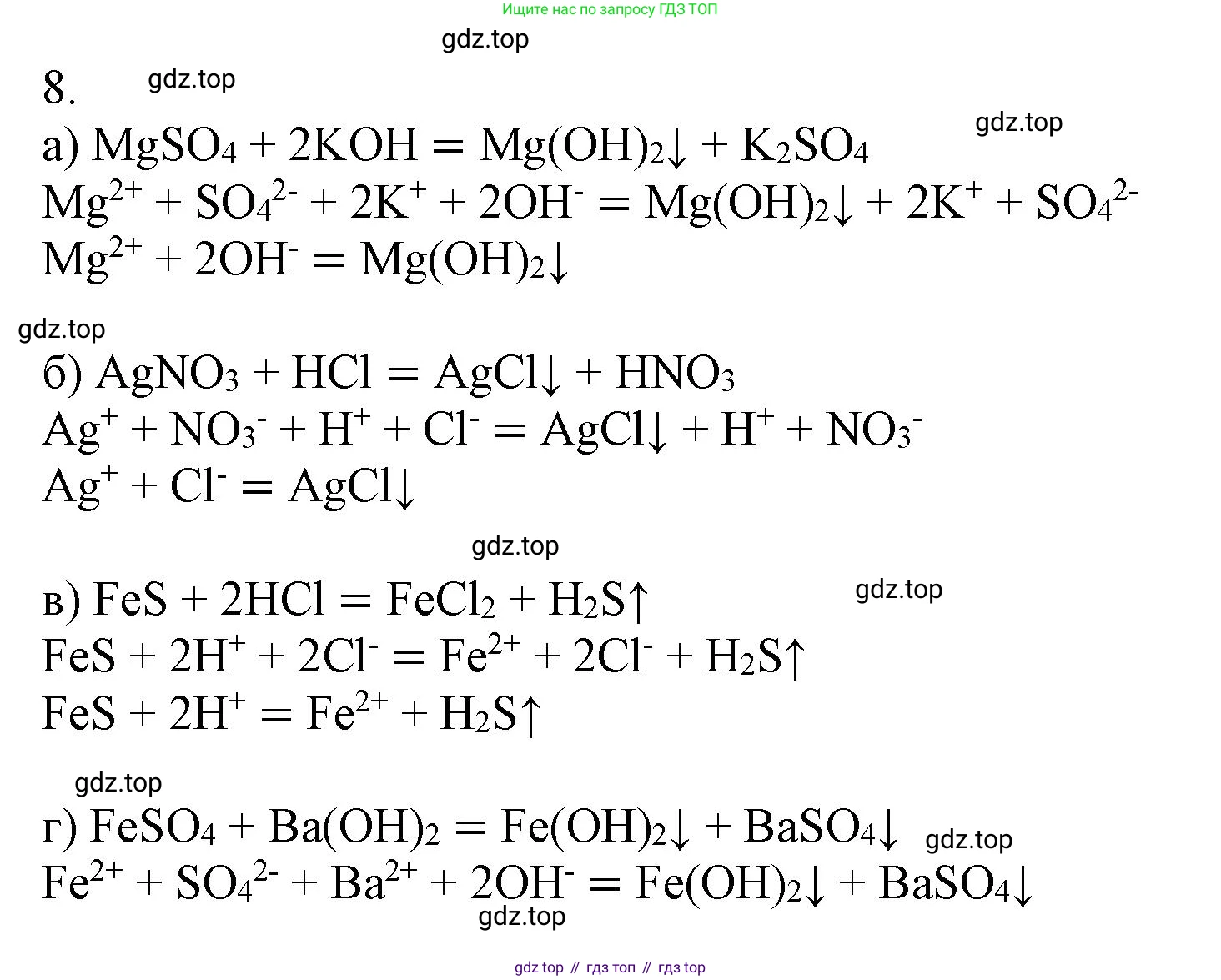
Решение 2. №8 (с. 72)
а) В данной реакции обмена одним из продуктов является сульфат калия $K_2SO_4$, значит, один из реагентов должен содержать ион калия $K^+$. Второй продукт — осадок, который должен содержать ион магния $Mg^{2+}$. Таким образом, реакция происходит между сульфатом магния $MgSO_4$ и гидроксидом калия $KOH$ с образованием нерастворимого гидроксида магния $Mg(OH)_2$.
Молекулярное уравнение: $MgSO_4 + 2KOH = Mg(OH)_2\downarrow + K_2SO_4$
Полное ионное уравнение: $Mg^{2+} + SO_4^{2-} + 2K^+ + 2OH^- = Mg(OH)_2\downarrow + 2K^+ + SO_4^{2-}$
Сокращённое ионное уравнение: $Mg^{2+} + 2OH^- = Mg(OH)_2\downarrow$
Ответ: Молекулярное уравнение: $MgSO_4 + 2KOH = Mg(OH)_2\downarrow + K_2SO_4$. Полное ионное уравнение: $Mg^{2+} + SO_4^{2-} + 2K^+ + 2OH^- = Mg(OH)_2\downarrow + 2K^+ + SO_4^{2-}$. Сокращённое ионное уравнение: $Mg^{2+} + 2OH^- = Mg(OH)_2\downarrow$.
б) Продуктами реакции являются азотная кислота $HNO_3$ и осадок. Это указывает на то, что исходное вещество содержало нитрат-ион $NO_3^-$. Осадок образуется при взаимодействии катиона этого вещества с хлорид-ионом $Cl^-$ из соляной кислоты $HCl$. Качественной реакцией на ион хлора является реакция с ионом серебра $Ag^+$. Следовательно, исходным веществом был нитрат серебра $AgNO_3$, а осадком — хлорид серебра $AgCl$.
Молекулярное уравнение: $AgNO_3 + HCl = AgCl\downarrow + HNO_3$
Полное ионное уравнение: $Ag^+ + NO_3^- + H^+ + Cl^- = AgCl\downarrow + H^+ + NO_3^-$
Сокращённое ионное уравнение: $Ag^+ + Cl^- = AgCl\downarrow$
Ответ: Молекулярное уравнение: $AgNO_3 + HCl = AgCl\downarrow + HNO_3$. Полное ионное уравнение: $Ag^+ + NO_3^- + H^+ + Cl^- = AgCl\downarrow + H^+ + NO_3^-$. Сокращённое ионное уравнение: $Ag^+ + Cl^- = AgCl\downarrow$.
в) Реакция сульфида железа(II) $FeS$ с кислотой. Продуктами являются соль железа(II) $FeCl_2$ и газ. При реакции сульфидов с сильными кислотами выделяется газ сероводород $H_2S$. Так как в продуктах хлорид железа(II), то в качестве кислоты нужно использовать соляную кислоту $HCl$.
Молекулярное уравнение: $FeS + 2HCl = FeCl_2 + H_2S\uparrow$
Полное ионное уравнение (сульфид железа(II) - нерастворимое вещество): $FeS + 2H^+ + 2Cl^- = Fe^{2+} + 2Cl^- + H_2S\uparrow$
Сокращённое ионное уравнение: $FeS + 2H^+ = Fe^{2+} + H_2S\uparrow$
Ответ: Молекулярное уравнение: $FeS + 2HCl = FeCl_2 + H_2S\uparrow$. Полное ионное уравнение: $FeS + 2H^+ + 2Cl^- = Fe^{2+} + 2Cl^- + H_2S\uparrow$. Сокращённое ионное уравнение: $FeS + 2H^+ = Fe^{2+} + H_2S\uparrow$.
г) В результате реакции образуются два осадка: гидроксид железа(II) $Fe(OH)_2$ и сульфат бария $BaSO_4$. Это означает, что в реакцию должны вступать растворимые вещества, содержащие ионы $Fe^{2+}$, $OH^-$, $Ba^{2+}$ и $SO_4^{2-}$. Такими веществами являются сульфат железа(II) $FeSO_4$ и гидроксид бария $Ba(OH)_2$.
Молекулярное уравнение: $FeSO_4 + Ba(OH)_2 = Fe(OH)_2\downarrow + BaSO_4\downarrow$
Полное ионное уравнение: $Fe^{2+} + SO_4^{2-} + Ba^{2+} + 2OH^- = Fe(OH)_2\downarrow + BaSO_4\downarrow$
Сокращённое ионное уравнение: Так как все ионы связываются в осадки, сокращённое ионное уравнение совпадает с полным. $Fe^{2+} + SO_4^{2-} + Ba^{2+} + 2OH^- = Fe(OH)_2\downarrow + BaSO_4\downarrow$
Ответ: Молекулярное уравнение: $FeSO_4 + Ba(OH)_2 = Fe(OH)_2\downarrow + BaSO_4\downarrow$. Полное ионное уравнение: $Fe^{2+} + SO_4^{2-} + Ba^{2+} + 2OH^- = Fe(OH)_2\downarrow + BaSO_4\downarrow$. Сокращённое ионное уравнение: $Fe^{2+} + SO_4^{2-} + Ba^{2+} + 2OH^- = Fe(OH)_2\downarrow + BaSO_4\downarrow$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 8 расположенного на странице 72 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 72), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















