Номер 4, страница 110 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химическая реакция. Параграф 21. Обратимые реакции. Химическое равновесие. Вопросы и задания - номер 4, страница 110.
№4 (с. 110)
Условие. №4 (с. 110)
скриншот условия
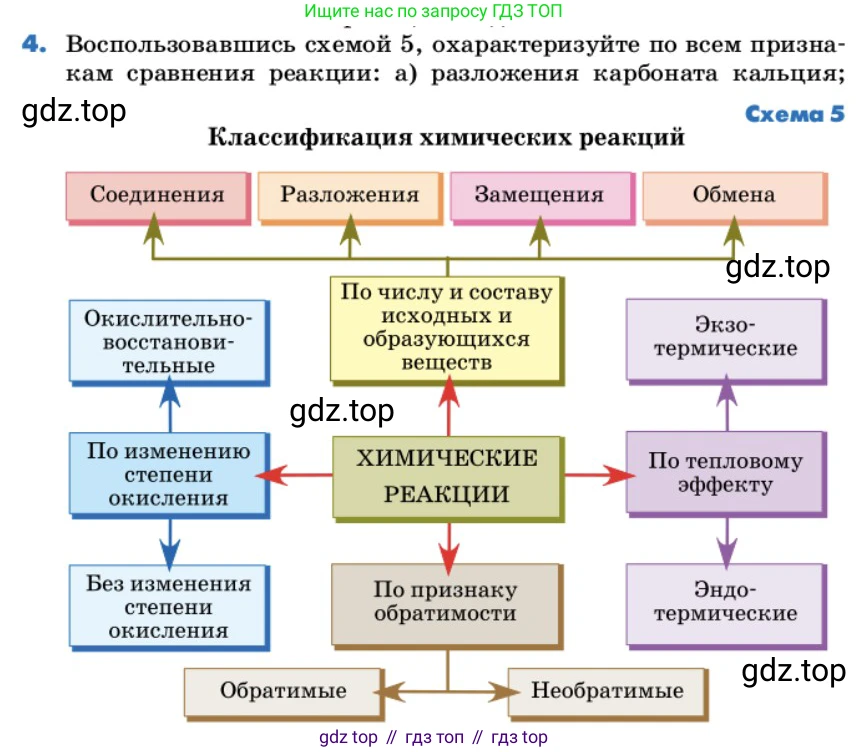

4. Воспользовавшись схемой 5, охарактеризуйте по всем признакам сравнения реакции: а) разложения карбоната кальция;
Схема 5
Классификация химических реакций
б) взаимодействия натрия с водой;
в) нейтрализации гидроксида натрия соляной кислотой.
Решение. №4 (с. 110)

Решение 2. №4 (с. 110)
Для характеристики каждой реакции воспользуемся классификацией, представленной на схеме 5. Необходимо определить тип реакции по четырём признакам: число и состав исходных и образующихся веществ, изменение степени окисления, тепловой эффект и обратимость.
а) разложение карбоната кальция;
Уравнение реакции: $CaCO_3 \xrightarrow{t^\circ} CaO + CO_2$
1. По числу и составу исходных и образующихся веществ: из одного сложного вещества ($CaCO_3$) образуются два других вещества ($CaO$ и $CO_2$). Это реакция разложения.
2. По изменению степени окисления: рассчитаем степени окисления элементов до и после реакции: $\stackrel{+2}{Ca}\stackrel{+4}{C}\stackrel{-2}{O}_3 \to \stackrel{+2}{Ca}\stackrel{-2}{O} + \stackrel{+4}{C}\stackrel{-2}{O}_2$. Степени окисления кальция ($+2$), углерода ($+4$) и кислорода ($-2$) не изменяются. Следовательно, реакция протекает без изменения степеней окисления.
3. По тепловому эффекту: реакция разложения карбоната кальция требует нагревания, то есть поглощает теплоту извне. Это эндотермическая реакция.
4. По признаку обратимости: так как в результате реакции образуется газообразное вещество ($CO_2$), которое покидает зону реакции, она является необратимой в обычных условиях.
Ответ: реакция разложения, без изменения степеней окисления, эндотермическая, необратимая.
б) взаимодействия натрия с водой;
Уравнение реакции: $2Na + 2H_2O \to 2NaOH + H_2 \uparrow$
1. По числу и составу исходных и образующихся веществ: простое вещество (натрий) вступает в реакцию со сложным веществом (вода), замещая в нём атомы водорода. Образуются новое сложное вещество (гидроксид натрия) и новое простое вещество (водород). Это реакция замещения.
2. По изменению степени окисления: определим степени окисления: $2\stackrel{0}{Na} + 2\stackrel{+1}{H}_2\stackrel{-2}{O} \to 2\stackrel{+1}{Na}\stackrel{-2}{O}\stackrel{+1}{H} + \stackrel{0}{H}_2$. Натрий изменяет степень окисления с $0$ до $+1$ (окисляется), а водород — с $+1$ до $0$ (восстанавливается). Следовательно, это окислительно-восстановительная реакция.
3. По тепловому эффекту: реакция протекает очень бурно, с выделением большого количества теплоты. Это экзотермическая реакция.
4. По признаку обратимости: выделение газа ($H_2$) приводит к тому, что реакция протекает только в одном направлении и является необратимой.
Ответ: реакция замещения, окислительно-восстановительная, экзотермическая, необратимая.
в) нейтрализации гидроксида натрия соляной кислотой.
Уравнение реакции: $NaOH + HCl \to NaCl + H_2O$
1. По числу и составу исходных и образующихся веществ: два сложных вещества (гидроксид натрия и соляная кислота) обмениваются своими составными частями (ионами). Это реакция обмена.
2. По изменению степени окисления: определим степени окисления: $\stackrel{+1}{Na}\stackrel{-2}{O}\stackrel{+1}{H} + \stackrel{+1}{H}\stackrel{-1}{Cl} \to \stackrel{+1}{Na}\stackrel{-1}{Cl} + \stackrel{+1}{H}_2\stackrel{-2}{O}$. Степени окисления всех элементов ($Na, O, H, Cl$) в ходе реакции не изменяются. Реакция протекает без изменения степеней окисления.
3. По тепловому эффекту: реакция нейтрализации кислоты основанием всегда протекает с выделением теплоты. Это экзотермическая реакция.
4. По признаку обратимости: в результате реакции образуется вода — очень слабо диссоциирующее вещество, что смещает равновесие в сторону продуктов. Реакция считается необратимой.
Ответ: реакция обмена, без изменения степеней окисления, экзотермическая, необратимая.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 110 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 110), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















