Номер 14, страница 49 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Химические реакции в водных растворах. Химические свойства оснований как электролитов. Вариант 2 - номер 14, страница 49.
№14 (с. 49)
Условие. №14 (с. 49)
скриншот условия

14. Гидроксид калия используют в качестве электролита в никель-кадмиевых аккумуляторах в сочетании с гидроксидом лития. Он также является исходным веществом для получения жидкого мыла, некоторых видов красителей и солей калия. Напишите уравнение реакции нейтрализации, приводящей к получению сульфата калия, в молекулярной и ионной форме.
Решение. №14 (с. 49)
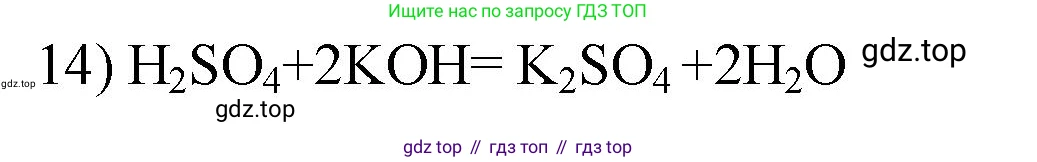

Решение 2. №14 (с. 49)
Решение
Для того чтобы получить сульфат калия ($K_2SO_4$) путем реакции нейтрализации, необходимо использовать гидроксид калия ($KOH$), который является основанием, и кислоту, содержащую сульфат-ион ($SO_4^{2-}$). Такой кислотой является серная кислота ($H_2SO_4$). Реакция нейтрализации — это реакция взаимодействия кислоты и основания, в результате которой образуются соль и вода.
Молекулярное уравнение
Запишем уравнение взаимодействия гидроксида калия с серной кислотой. Чтобы уравнять количество атомов калия, водорода и кислорода в левой и правой частях, необходимо расставить коэффициенты. На две формульные единицы гидроксида калия потребуется одна молекула серной кислоты, в результате чего образуется одна формульная единица сульфата калия и две молекулы воды.
Ответ: $2KOH + H_2SO_4 = K_2SO_4 + 2H_2O$
Ионные уравнения
Для составления ионных уравнений необходимо записать сильные электролиты в диссоциированном виде (в виде ионов). Гидроксид калия ($KOH$) является сильным основанием, серная кислота ($H_2SO_4$) — сильной кислотой, а сульфат калия ($K_2SO_4$) — растворимой солью. Все они являются сильными электролитами. Вода ($H_2O$) — слабый электролит, поэтому ее формула записывается в молекулярном виде.
Полное ионное уравнение включает все ионы, находящиеся в растворе до и после реакции:
$2K^+ + 2OH^- + 2H^+ + SO_4^{2-} = 2K^+ + SO_4^{2-} + 2H_2O$
Для получения сокращенного ионного уравнения необходимо исключить из обеих частей полного ионного уравнения одинаковые ионы (ионы-наблюдатели), которые не принимают участия в реакции. В данном случае это ионы $K^+$ и $SO_4^{2-}$. Сокращенное ионное уравнение отражает суть химического процесса.
$2H^+ + 2OH^- = 2H_2O$
Коэффициенты в сокращенном ионном уравнении можно сократить на 2:
$H^+ + OH^- = H_2O$
Ответ:
Полное ионное уравнение: $2K^+ + 2OH^- + 2H^+ + SO_4^{2-} = 2K^+ + SO_4^{2-} + 2H_2O$
Сокращенное ионное уравнение: $H^+ + OH^- = H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 14 расположенного на странице 49 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №14 (с. 49), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















