Номер 7, страница 154 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава IV. Металлы и их соединения. §29. Химические свойства металлов. Примените свои знания - номер 7, страница 154.
№7 (с. 154)
Условие. №7 (с. 154)
скриншот условия

7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
a) $CuO \rightarrow Cu \rightarrow Cu(NO_3)_2 \rightarrow Cu(OH)_2 \rightarrow CuO \rightarrow CuCl_2$
б) $Na \rightarrow NaOH \rightarrow NaHSO_4 \rightarrow Na_2SO_4 \rightarrow BaSO_4$
в) $ZnS \rightarrow ZnO \rightarrow Zn \rightarrow ZnSO_4 \rightarrow ZnCl_2 \rightarrow ZnCO_3 \rightarrow ZnO$
г) $MgCl_2 \rightarrow Mg \rightarrow MgO \rightarrow MgSO_4 \rightarrow Mg(OH)_2 \rightarrow Mg(NO_3)_2$
Решение. №7 (с. 154)
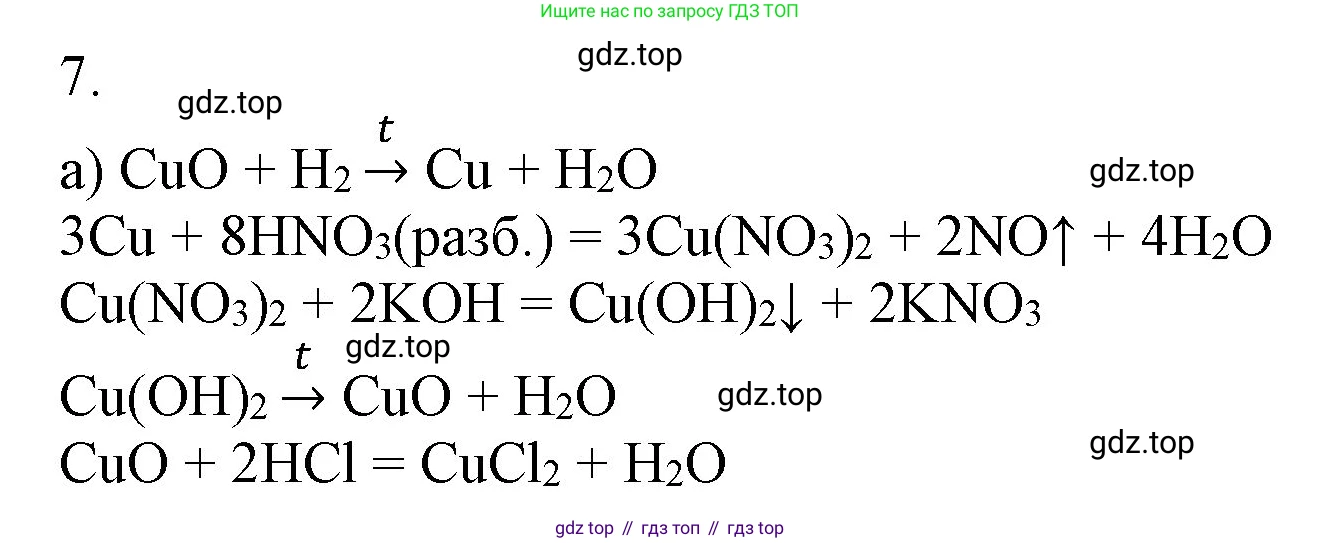

Решение 2. №7 (с. 154)
а) Решение:
Для осуществления цепочки превращений $CuO \rightarrow Cu \rightarrow Cu(NO_3)_2 \rightarrow Cu(OH)_2 \rightarrow CuO \rightarrow CuCl_2$ запишем следующие уравнения реакций:
1. Восстановление оксида меди(II) до металлической меди можно провести с помощью водорода при нагревании:
$CuO + H_2 \xrightarrow{t} Cu + H_2O$
2. Медь взаимодействует с концентрированной азотной кислотой с образованием нитрата меди(II), оксида азота(IV) и воды:
$Cu + 4HNO_3(\text{конц.}) \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
3. Для получения гидроксида меди(II) к раствору нитрата меди(II) необходимо добавить раствор щелочи, например, гидроксид натрия. В результате реакции обмена выпадает голубой осадок гидроксида меди(II):
$Cu(NO_3)_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaNO_3$
4. Гидроксид меди(II) является неустойчивым соединением и при нагревании разлагается на оксид меди(II) и воду:
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
5. Оксид меди(II) как основный оксид реагирует с соляной кислотой, образуя соль хлорид меди(II) и воду:
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Ответ:
$CuO + H_2 \xrightarrow{t} Cu + H_2O$
$Cu + 4HNO_3(\text{конц.}) \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
$Cu(NO_3)_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaNO_3$
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
б) Решение:
Для осуществления цепочки превращений $Na \rightarrow NaOH \rightarrow NaHSO_4 \rightarrow Na_2SO_4 \rightarrow BaSO_4$ запишем следующие уравнения реакций:
1. Металлический натрий бурно реагирует с водой с образованием гидроксида натрия и выделением водорода:
$2Na + 2H_2O \rightarrow 2NaOH + H_2\uparrow$
2. Для получения кислой соли гидросульфата натрия необходимо провести реакцию гидроксида натрия с избытком серной кислоты:
$NaOH + H_2SO_4(\text{изб.}) \rightarrow NaHSO_4 + H_2O$
3. Чтобы из кислой соли получить среднюю соль, нужно добавить к гидросульфату натрия щелочь (гидроксид натрия):
$NaHSO_4 + NaOH \rightarrow Na_2SO_4 + H_2O$
4. Сульфат бария является нерастворимым веществом. Его можно получить реакцией ионного обмена, добавив к раствору сульфата натрия раствор растворимой соли бария, например, хлорида бария:
$Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$
Ответ:
$2Na + 2H_2O \rightarrow 2NaOH + H_2\uparrow$
$NaOH + H_2SO_4(\text{изб.}) \rightarrow NaHSO_4 + H_2O$
$NaHSO_4 + NaOH \rightarrow Na_2SO_4 + H_2O$
$Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$
в) Решение:
Для осуществления цепочки превращений $ZnS \rightarrow ZnO \rightarrow Zn \rightarrow ZnSO_4 \rightarrow ZnCl_2 \rightarrow ZnCO_3 \rightarrow ZnO$ запишем следующие уравнения реакций:
1. Обжиг сульфида цинка в токе кислорода приводит к образованию оксида цинка и диоксида серы:
$2ZnS + 3O_2 \xrightarrow{t} 2ZnO + 2SO_2\uparrow$
2. Восстановление оксида цинка до металлического цинка в промышленности проводят с помощью кокса (углерода) при высокой температуре:
$ZnO + C \xrightarrow{t} Zn + CO\uparrow$
3. Цинк, как металл, стоящий в ряду активности до водорода, реагирует с разбавленной серной кислотой с образованием сульфата цинка и водорода:
$Zn + H_2SO_4(\text{разб.}) \rightarrow ZnSO_4 + H_2\uparrow$
4. Чтобы получить хлорид цинка из сульфата цинка, можно использовать реакцию обмена с хлоридом бария. В результате образуется нерастворимый сульфат бария, который можно отделить:
$ZnSO_4 + BaCl_2 \rightarrow ZnCl_2 + BaSO_4\downarrow$
5. Карбонат цинка — нерастворимая соль, которую можно получить, добавив к раствору хлорида цинка раствор карбоната натрия:
$ZnCl_2 + Na_2CO_3 \rightarrow ZnCO_3\downarrow + 2NaCl$
6. Карбонат цинка при нагревании разлагается на оксид цинка и углекислый газ:
$ZnCO_3 \xrightarrow{t} ZnO + CO_2\uparrow$
Ответ:
$2ZnS + 3O_2 \xrightarrow{t} 2ZnO + 2SO_2\uparrow$
$ZnO + C \xrightarrow{t} Zn + CO\uparrow$
$Zn + H_2SO_4(\text{разб.}) \rightarrow ZnSO_4 + H_2\uparrow$
$ZnSO_4 + BaCl_2 \rightarrow ZnCl_2 + BaSO_4\downarrow$
$ZnCl_2 + Na_2CO_3 \rightarrow ZnCO_3\downarrow + 2NaCl$
$ZnCO_3 \xrightarrow{t} ZnO + CO_2\uparrow$
г) Решение:
Для осуществления цепочки превращений $MgCl_2 \rightarrow Mg \rightarrow MgO \rightarrow MgSO_4 \rightarrow Mg(OH)_2 \rightarrow Mg(NO_3)_2$ запишем следующие уравнения реакций:
1. Металлический магний получают электролизом расплава его хлорида:
$MgCl_2(\text{расплав}) \xrightarrow{\text{электролиз}} Mg + Cl_2\uparrow$
2. Магний легко горит на воздухе (в кислороде) с образованием оксида магния:
$2Mg + O_2 \xrightarrow{t} 2MgO$
3. Оксид магния, являясь основным оксидом, реагирует с серной кислотой с образованием сульфата магния и воды:
$MgO + H_2SO_4 \rightarrow MgSO_4 + H_2O$
4. Гидроксид магния — нерастворимое основание. Его можно получить, добавив к раствору сульфата магния щелочь, например, гидроксид калия:
$MgSO_4 + 2KOH \rightarrow Mg(OH)_2\downarrow + K_2SO_4$
5. Гидроксид магния реагирует с азотной кислотой (реакция нейтрализации) с образованием нитрата магния и воды:
$Mg(OH)_2 + 2HNO_3 \rightarrow Mg(NO_3)_2 + 2H_2O$
Ответ:
$MgCl_2(\text{расплав}) \xrightarrow{\text{электролиз}} Mg + Cl_2\uparrow$
$2Mg + O_2 \xrightarrow{t} 2MgO$
$MgO + H_2SO_4 \rightarrow MgSO_4 + H_2O$
$MgSO_4 + 2KOH \rightarrow Mg(OH)_2\downarrow + K_2SO_4$
$Mg(OH)_2 + 2HNO_3 \rightarrow Mg(NO_3)_2 + 2H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 7 расположенного на странице 154 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 154), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















