Номер 7, страница 201 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава V. Химия и окружающая среда. §38. Охрана окружающей среды от химического загрязнения. Примените свои знания - номер 7, страница 201.
№7 (с. 201)
Условие. №7 (с. 201)
скриншот условия

7. Составьте уравнения реакций образования кислотных дождей.
Решение. №7 (с. 201)
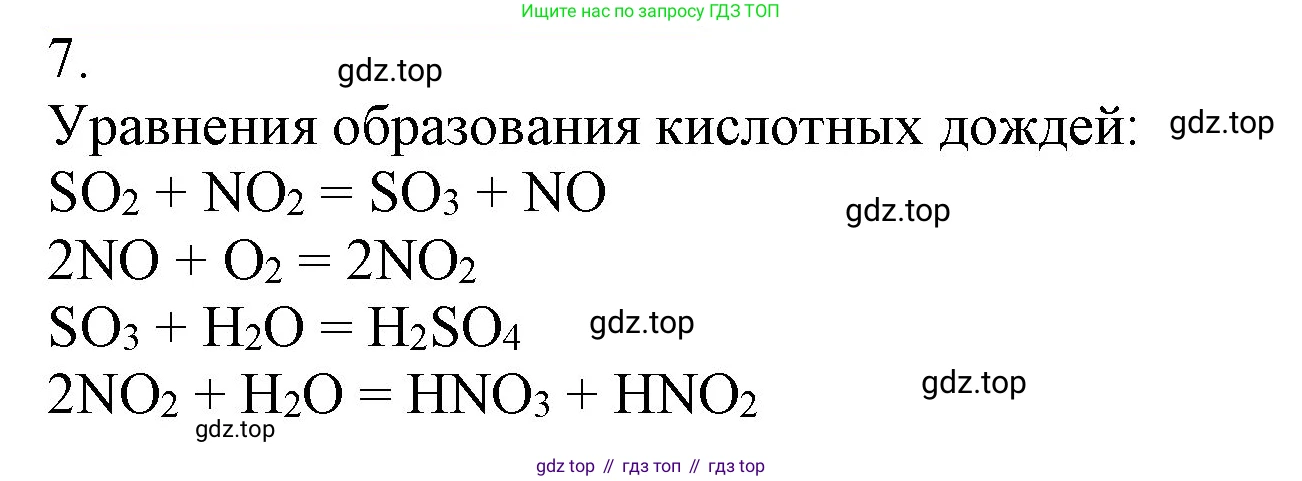
Решение 2. №7 (с. 201)
Кислотные дожди — это все виды атмосферных осадков, таких как дождь, снег, град и туман, кислотность которых превышает нормальный уровень (обычно pH ниже 5.6). Основной причиной их возникновения являются выбросы в атмосферу оксидов серы $(SO_x)$ и азота $(NO_x)$ в результате промышленной деятельности, работы теплоэлектростанций и сжигания топлива в автомобилях.
Образование серной и сернистой кислот
Процесс формирования серной кислоты, основного компонента кислотных дождей в промышленных районах, происходит в несколько этапов.
1. Сжигание серосодержащего топлива. При сжигании ископаемого топлива (угля, мазута), которое содержит серу в качестве примеси, образуется диоксид серы (сернистый газ):
$S + O_2 \rightarrow SO_2$
2. Окисление диоксида серы. В атмосфере диоксид серы медленно окисляется кислородом воздуха до триоксида серы. Эта реакция ускоряется (катализируется) наличием в воздухе частиц пыли, соединений железа или марганца, а также под действием солнечного света:
$2SO_2 + O_2 \rightleftharpoons 2SO_3$
3. Образование кислот. Триоксид серы очень активно реагирует с водяным паром в атмосфере, образуя сильную серную кислоту, которая выпадает на землю в виде кислотного дождя:
$SO_3 + H_2O \rightarrow H_2SO_4$
Также диоксид серы может напрямую растворяться в каплях воды, образуя слабую сернистую кислоту:
$SO_2 + H_2O \rightleftharpoons H_2SO_3$
Сернистая кислота затем может быть окислена в атмосфере до серной.
Ответ: Ключевые реакции образования серной кислоты: $S + O_2 \rightarrow SO_2$; $2SO_2 + O_2 \rightarrow 2SO_3$; $SO_3 + H_2O \rightarrow H_2SO_4$.
Образование азотной и азотистой кислот
Оксиды азота, второй основной источник кислотных дождей, образуются преимущественно при высоких температурах.
1. Образование монооксида азота. При очень высоких температурах, например в двигателях внутреннего сгорания или во время грозовых разрядов, атмосферный азот реагирует с кислородом:
$N_2 + O_2 \xrightarrow{t^\circ} 2NO$
2. Окисление монооксида азота. Образовавшийся бесцветный газ NO в атмосфере довольно быстро окисляется кислородом до диоксида азота $(NO_2)$ — газа бурого цвета с характерным запахом:
$2NO + O_2 \rightarrow 2NO_2$
3. Образование кислот. Диоксид азота реагирует с водой, образуя смесь сильной азотной и слабой азотистой кислот:
$2NO_2 + H_2O \rightarrow HNO_3 + HNO_2$
В присутствии кислорода, растворенного в воде, весь диоксид азота превращается в азотную кислоту. Эта реакция является основным путем образования азотной кислоты в каплях облаков и тумана:
$4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$
Ответ: Ключевые реакции образования азотной кислоты: $N_2 + O_2 \rightarrow 2NO$; $2NO + O_2 \rightarrow 2NO_2$; $4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$.
Для полноты картины следует упомянуть, что даже незагрязненная дождевая вода является слабокислой (pH ≈ 5.6). Это связано с растворением в ней углекислого газа $(CO_2)$ из атмосферы и образованием слабой угольной кислоты:
$CO_2 + H_2O \rightleftharpoons H_2CO_3$
Эта реакция является естественным процессом и не считается причиной проблемы кислотных дождей, которая вызвана антропогенными загрязнителями.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 7 расположенного на странице 201 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 201), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















