Номер 2, страница 64 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §15. Кислородные соединения серы. Часть 2 - номер 2, страница 64.
№2 (с. 64)
Условие. №2 (с. 64)
скриншот условия

2. Дополните схемы реакций. Расставьте коэффициенты с помощью метода электронного баланса.
a) $SO_2 + HNO_3 \rightarrow NO_2 + \text{_____}$
б) $H_2SO_4 + Zn \rightarrow S + \text{_____} + \text{_____}$
Решение. №2 (с. 64)
Решение 2. №2 (с. 64)
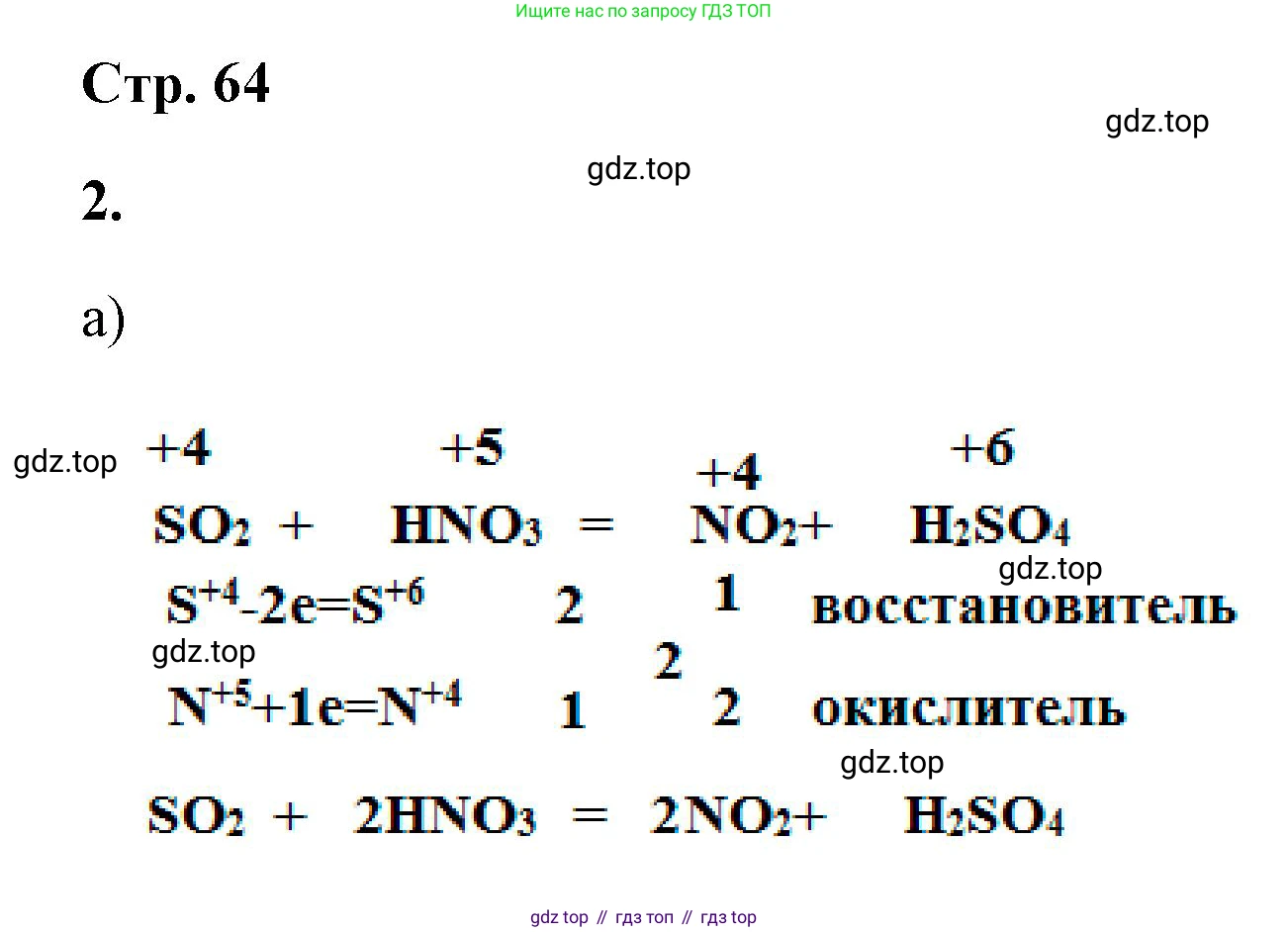
а) SO₂ + HNO₃ → NO₂ + ___
Решение
Это окислительно-восстановительная реакция. Азотная кислота является сильным окислителем, а диоксид серы (сернистый газ) — восстановителем. В ходе реакции сера в степени окисления +4 (в $SO_2$) окисляется до своей высшей степени окисления +6, образуя серную кислоту ($H_2SO_4$). Азот в степени окисления +5 (в $HNO_3$) восстанавливается до +4, образуя диоксид азота ($NO_2$).
Схема реакции: $SO_2 + HNO_3 \rightarrow H_2SO_4 + NO_2$
Определим степени окисления элементов, участвующих в реакции:
$\overset{+4}{S}O_2 + H\overset{+5}{N}O_3 \rightarrow H_2\overset{+6}{S}O_4 + \overset{+4}{N}O_2$
Составим электронный баланс, чтобы найти коэффициенты:
$S^{+4} - 2e^- \rightarrow S^{+6} \quad| 1 \quad$ (процесс окисления, $SO_2$ — восстановитель)
$N^{+5} + 1e^- \rightarrow N^{+4} \quad| 2 \quad$ (процесс восстановления, $HNO_3$ — окислитель)
Найденные множители (1 и 2) являются коэффициентами для соответствующих веществ. Поставим коэффициент 2 перед $HNO_3$ и $NO_2$, а коэффициент 1 (не пишется) перед $SO_2$ и $H_2SO_4$.
$SO_2 + 2HNO_3 \rightarrow H_2SO_4 + 2NO_2$
Проверим, уравновешены ли атомы всех элементов:
Слева: S = 1, H = 2, N = 2, O = 2 + 2·3 = 8
Справа: S = 1, H = 2, N = 2, O = 4 + 2·2 = 8
Все элементы уравновешены, коэффициенты расставлены верно.
Ответ: $SO_2 + 2HNO_3 \rightarrow H_2SO_4 + 2NO_2$.
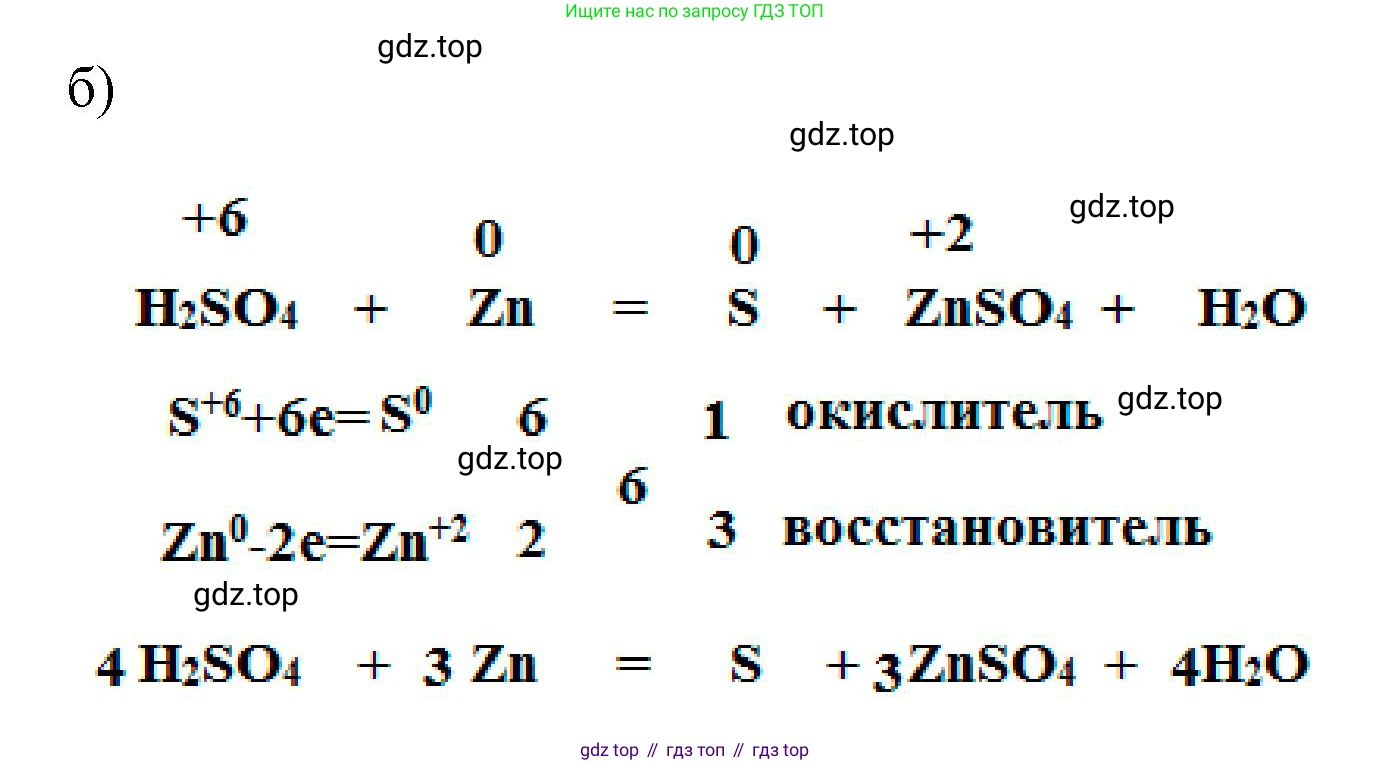
б) H₂SO₄ + Zn → S + ___ + ___
Решение
Это реакция взаимодействия концентрированной серной кислоты с цинком. В таких реакциях серная кислота выступает в роли окислителя за счет серы в степени окисления +6. Продукты восстановления серы зависят от активности металла и концентрации кислоты. В данном случае, по условию, сера восстанавливается до степени окисления 0 (простое вещество S). Цинк, как активный металл, окисляется до степени окисления +2, образуя соль — сульфат цинка ($ZnSO_4$). Также в реакции образуется вода ($H_2O$).
Схема реакции: $H_2SO_4 + Zn \rightarrow S + ZnSO_4 + H_2O$
Определим степени окисления элементов, участвующих в реакции:
$H_2\overset{+6}{S}O_4 + \overset{0}{Zn} \rightarrow \overset{0}{S} + \overset{+2}{Zn}SO_4 + H_2O$
Составим электронный баланс:
$Zn^{0} - 2e^- \rightarrow Zn^{+2} \quad| 3 \quad$ (процесс окисления, $Zn$ — восстановитель)
$S^{+6} + 6e^- \rightarrow S^{0} \quad| 1 \quad$ (процесс восстановления, $H_2SO_4$ — окислитель)
Коэффициент 3 ставим перед $Zn$ и $ZnSO_4$. Коэффициент 1 (не пишется) ставим перед серой ($S$), которая восстановилась.
$_H_2SO_4 + 3Zn \rightarrow S + 3ZnSO_4 + _H_2O$
Теперь уравняем общее количество атомов серы. Справа у нас 1 атом серы в простом веществе и 3 атома серы в сульфате цинка, итого 4 атома. Следовательно, слева нужно взять 4 молекулы $H_2SO_4$.
$4H_2SO_4 + 3Zn \rightarrow S + 3ZnSO_4 + _H_2O$
Осталось уравнять водород и кислород. Слева 4·2 = 8 атомов водорода. Значит, справа перед водой нужно поставить коэффициент 4.
$4H_2SO_4 + 3Zn \rightarrow S + 3ZnSO_4 + 4H_2O$
Проверим баланс по кислороду:
Слева: 4·4 = 16 атомов O
Справа: 3·4 + 4 = 12 + 4 = 16 атомов O
Все элементы уравновешены, коэффициенты расставлены верно.
Ответ: $4H_2SO_4 + 3Zn \rightarrow S + 3ZnSO_4 + 4H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 64 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 64), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















