Номер 2, страница 80 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §18. (продолжение). Соли азотной кислоты. Часть 2 - номер 2, страница 80.
№2 (с. 80)
Условие. №2 (с. 80)
скриншот условия

2. Расставьте коэффициенты в схемах реакций с помощью метода электронного баланса.
a)$HNO_3$ + $HCl$ + $Au$ → $AuCl_3$ + $NO$ + _______
б)$KNO_3$ + $Al$ → $KAlO_2$ + $Al_2O_3$ + $N_2$
в)$KNO_3$ + $C$ + $S$ → $N_2$ + $CO_2$ + $K_2S$
Решение. №2 (с. 80)
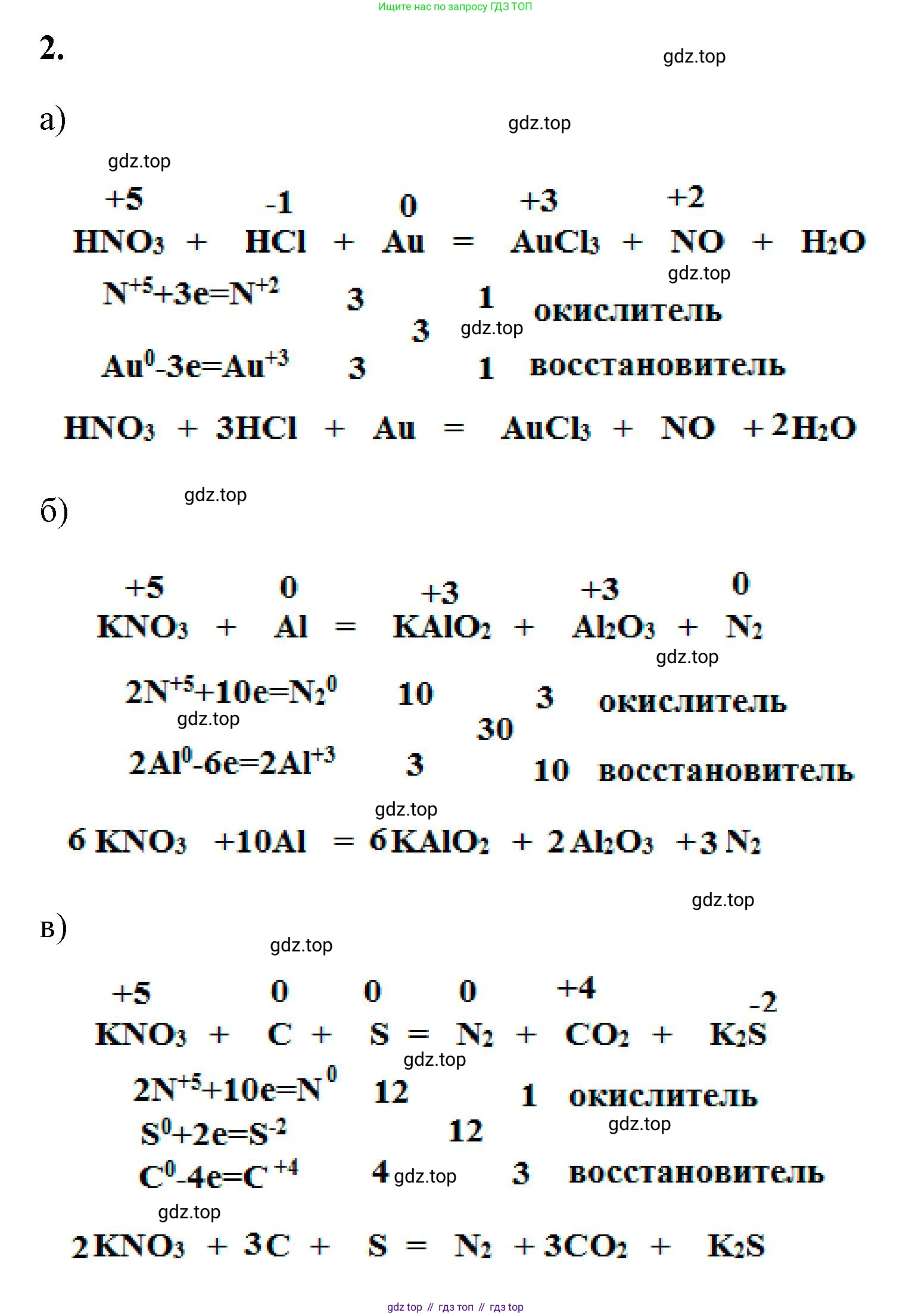
Решение 2. №2 (с. 80)
а)
Решение
Исходная схема реакции: $HNO_3 + HCl + Au \rightarrow AuCl_3 + NO + ...$
Данная реакция описывает растворение золота в смеси концентрированных азотной и соляной кислот («царской водке»). В результате реакции, помимо указанных продуктов, образуется вода. Таким образом, полная схема реакции выглядит так:
$HNO_3 + HCl + Au \rightarrow AuCl_3 + NO + H_2O$
1. Определим степени окисления элементов, чтобы найти окислитель и восстановитель.
$H^{+1}N^{+5}O_3^{-2} + H^{+1}Cl^{-1} + Au^0 \rightarrow Au^{+3}Cl_3^{-1} + N^{+2}O^{-2} + H_2^{+1}O^{-2}$
2. Составим полуреакции для элементов, изменивших степень окисления.
Золото является восстановителем, оно отдает электроны и окисляется:
$Au^0 - 3e^- \rightarrow Au^{+3}$
Азот в азотной кислоте является окислителем, он принимает электроны и восстанавливается:
$N^{+5} + 3e^- \rightarrow N^{+2}$
3. Составим электронный баланс, чтобы найти коэффициенты.
$Au^0 - 3e^- \rightarrow Au^{+3}$ | 1 | процесс окисления, Au – восстановитель
$N^{+5} + 3e^- \rightarrow N^{+2}$ | 1 | процесс восстановления, $N^{+5}$ – окислитель
Количество отданных и принятых электронов совпадает (3), поэтому множители равны 1. Это означает, что на 1 атом Au приходится 1 молекула $HNO_3$.
4. Подставим найденные коэффициенты в уравнение:
$1HNO_3 + HCl + 1Au \rightarrow 1AuCl_3 + 1NO + H_2O$
5. Уравняем остальные атомы.
Справа в $AuCl_3$ находится 3 атома хлора, следовательно, слева перед $HCl$ нужно поставить коэффициент 3.
$HNO_3 + 3HCl + Au \rightarrow AuCl_3 + NO + H_2O$
Теперь посчитаем атомы водорода слева: 1 в $HNO_3$ и 3 в $3HCl$, всего 4. Чтобы уравнять водород, справа перед $H_2O$ нужно поставить коэффициент 2 ($2 \times 2 = 4$ атома H).
$HNO_3 + 3HCl + Au \rightarrow AuCl_3 + NO + 2H_2O$
6. Проверим баланс по кислороду. Слева в $HNO_3$ 3 атома кислорода. Справа 1 атом в $NO$ и 2 атома в $2H_2O$, всего $1+2=3$. Баланс соблюден.
Ответ: $HNO_3 + 3HCl + Au \rightarrow AuCl_3 + NO + 2H_2O$.
б)
Решение
1. Определим степени окисления элементов в реакции:
$K^{+1}N^{+5}O_3^{-2} + Al^0 \rightarrow K^{+1}Al^{+3}O_2^{-2} + Al_2^{+3}O_3^{-2} + N_2^0$
2. Составим полуреакции для элементов, изменивших степень окисления.
Алюминий является восстановителем (окисляется):
$Al^0 - 3e^- \rightarrow Al^{+3}$
Азот в нитрате калия является окислителем (восстанавливается):
$2N^{+5} + 10e^- \rightarrow N_2^0$ (учитываем, что молекула азота двухатомная)
3. Составим электронный баланс.
$Al^0 - 3e^- \rightarrow Al^{+3}$ | 10 | процесс окисления, Al – восстановитель
$2N^{+5} + 10e^- \rightarrow N_2^0$ | 3 | процесс восстановления, $N^{+5}$ – окислитель
Наименьшее общее кратное для чисел отданных (3) и принятых (10) электронов равно 30. Находим множители: $30/3=10$ для алюминия и $30/10=3$ для азота.
4. Подставим коэффициенты в уравнение. Перед алюминием ставим 10. Перед $N_2$ ставим 3. Так как в $KNO_3$ один атом азота, а в процессе восстановления участвуют $3 \times 2 = 6$ атомов азота, то перед $KNO_3$ ставим коэффициент 6.
$6KNO_3 + 10Al \rightarrow KAlO_2 + Al_2O_3 + 3N_2$
5. Уравняем остальные элементы.
Слева 6 атомов калия, значит, справа перед алюминатом калия $KAlO_2$ ставим коэффициент 6.
$6KNO_3 + 10Al \rightarrow 6KAlO_2 + Al_2O_3 + 3N_2$
Теперь уравняем алюминий. Слева 10 атомов. Справа 6 атомов в $6KAlO_2$. Оставшиеся $10-6=4$ атома должны быть в оксиде алюминия $Al_2O_3$. Следовательно, перед $Al_2O_3$ ставим коэффициент 2 ($2 \times 2 = 4$ атома Al).
$6KNO_3 + 10Al \rightarrow 6KAlO_2 + 2Al_2O_3 + 3N_2$
6. Проверим баланс по кислороду. Слева $6 \times 3 = 18$ атомов. Справа $6 \times 2$ (в $6KAlO_2$) $+ 2 \times 3$ (в $2Al_2O_3$) $= 12 + 6 = 18$ атомов. Баланс соблюден.
Ответ: $6KNO_3 + 10Al \rightarrow 6KAlO_2 + 2Al_2O_3 + 3N_2$.
в)
Решение
1. Определим степени окисления элементов в реакции:
$K^{+1}N^{+5}O_3^{-2} + C^0 + S^0 \rightarrow N_2^0 + C^{+4}O_2^{-2} + K_2^{+1}S^{-2}$
2. В этой реакции один восстановитель и два элемента, принимающих электроны. Углерод окисляется, а азот и сера восстанавливаются.
Восстановитель (окисляется): $C^0 - 4e^- \rightarrow C^{+4}$
Окислитель (восстанавливается): $N^{+5} + 5e^- \rightarrow N^0$
Принимает электроны: $S^0 + 2e^- \rightarrow S^{-2}$
3. Составим электронный баланс. Общее число электронов, отданных восстановителем (углеродом), должно быть равно сумме электронов, принятых азотом и серой.
$C^0 - 4e^- \rightarrow C^{+4}$ | a | процесс окисления, C – восстановитель
$2N^{+5} + 10e^- \rightarrow N_2^0$ | b | процесс восстановления, $N^{+5}$ – окислитель
$S^0 + 2e^- \rightarrow S^{-2}$ | c | процесс восстановления
4. Запишем уравнение баланса электронов, где $a, b, c$ – множители для каждой полуреакции:
Число отданных электронов: $4a$.
Число принятых электронов: $10b + 2c$.
$4a = 10b + 2c$, что можно упростить до $2a = 5b + c$.
5. Используем баланс атомов калия для нахождения связи между коэффициентами. Калий слева находится в $KNO_3$, справа - в $K_2S$.
Количество молекул $KNO_3$ определяется количеством атомов азота, участвующих в реакции: $2b$. Значит, слева $2b$ атомов K.
Количество молекул $K_2S$ определяется количеством атомов серы: $c$. Значит, справа $2c$ атомов K.
Следовательно, $2b = 2c$, откуда $b = c$.
6. Подставим $c=b$ в уравнение электронного баланса:
$2a = 5b + b \rightarrow 2a = 6b \rightarrow a = 3b$.
7. Мы получили соотношение множителей: $a:b:c = 3b:b:b = 3:1:1$. Выберем наименьшие целые значения: $a=3, b=1, c=1$.
Теперь определим коэффициенты в уравнении реакции:
перед C и $CO_2$ (связано с $a$): 3
перед S и $K_2S$ (связано с $c$): 1
перед $N_2$ (связано с $b$): 1
перед $KNO_3$ (содержит $2b$ атомов N): 2
8. Запишем итоговое уравнение:
$2KNO_3 + 3C + S \rightarrow N_2 + 3CO_2 + K_2S$
9. Проверим баланс по кислороду. Слева в $2KNO_3$ имеется $2 \times 3 = 6$ атомов. Справа в $3CO_2$ имеется $3 \times 2 = 6$ атомов. Баланс соблюден.
Ответ: $2KNO_3 + 3C + S \rightarrow N_2 + 3CO_2 + K_2S$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 80 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 80), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















