Номер 3, страница 82 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §19. Фосфор и его соединения. Часть 1 - номер 3, страница 82.
№3 (с. 82)
Условие. №3 (с. 82)
скриншот условия
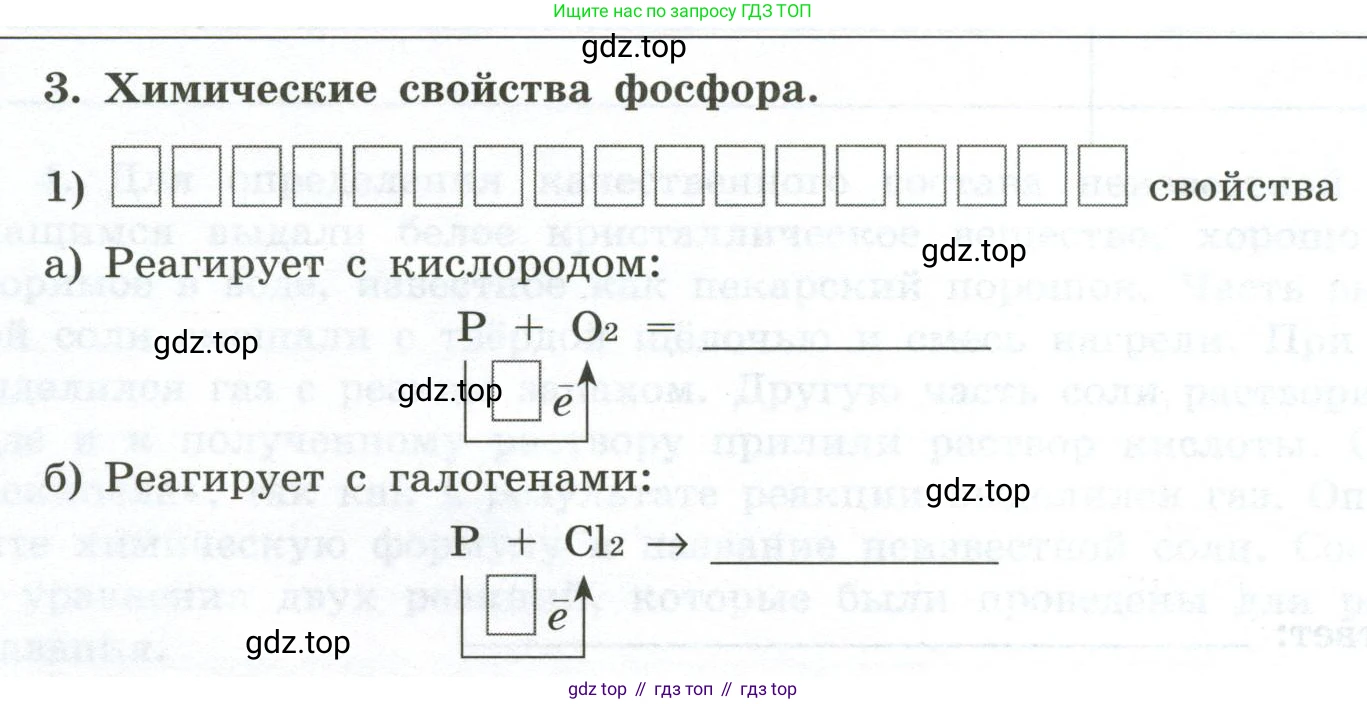

3. Химические свойства фосфора.
1) ____ свойства
a) Реагирует с кислородом:
$P + O_2 = \text{______}$
$\boxed{\uparrow e^-}$
б) Реагирует с галогенами:
$P + Cl_2 \rightarrow \text{______}$
$\boxed{\downarrow e^-}$
в) Реагирует со сложными веществами:
$P + HNO_3 = \text{______} + \text{______}$
Составьте электронный баланс, укажите окислитель и восстановитель, процессы окисления и восстановления.
2) ____ свойства
Реагирует с металлами:
$P + Mg = \text{______}$
$\boxed{\downarrow e^-}$
Продукты взаимодействия — ____.
Фосфиды щелочных и щелочноземельных металлов легко разлагаются водой (а), при этом образуется ____ (б):
a) ____________________
б) ____________________
Решение. №3 (с. 82)

Решение 2. №3 (с. 82)
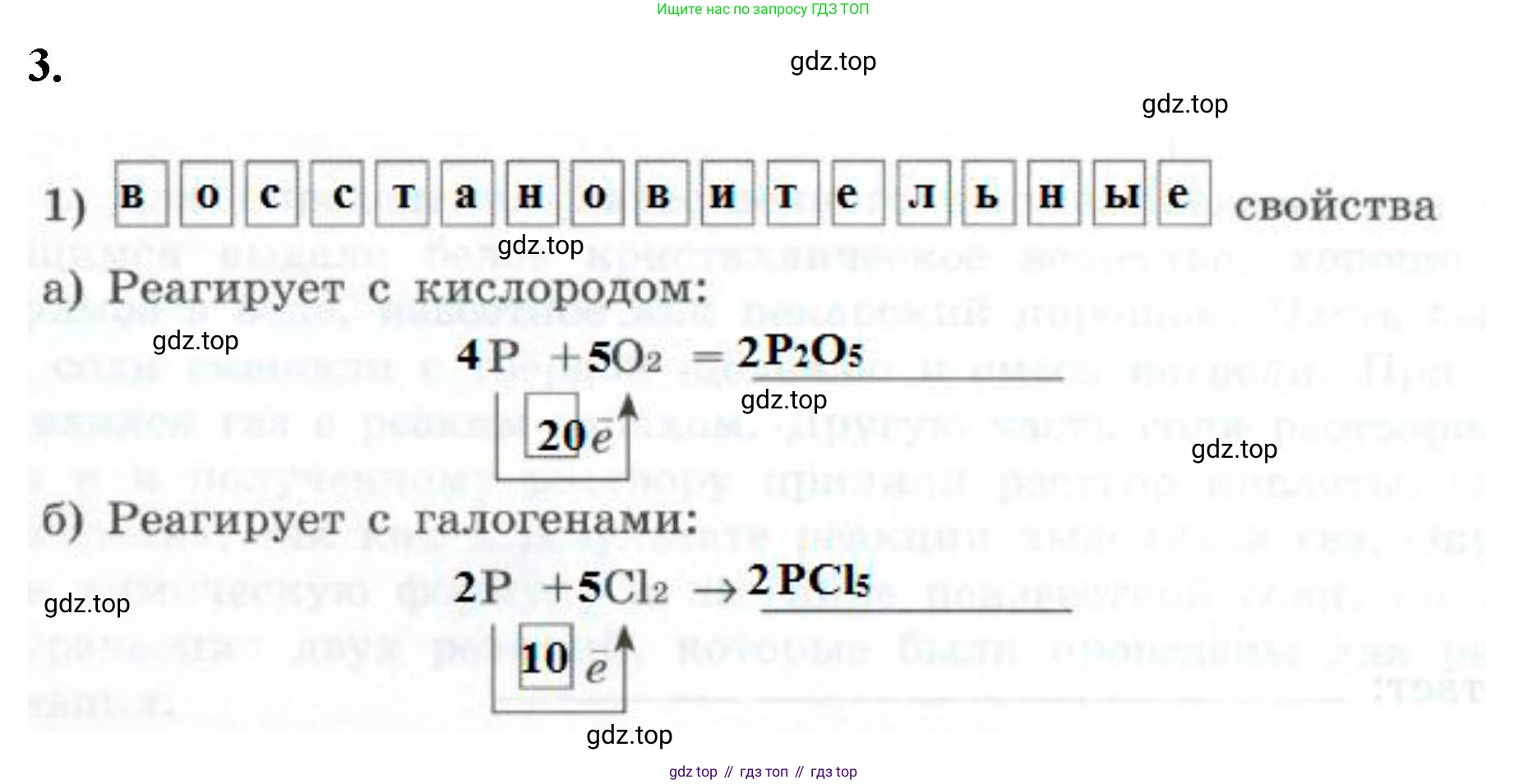
1) Восстановительные свойства
а) Реагирует с кислородом:
Фосфор сгорает в избытке кислорода с образованием оксида фосфора(V). В этой реакции фосфор является восстановителем, он отдает электроны.
Уравнение реакции: $4P + 5O_2 = 2P_2O_5$
Атом фосфора отдает 5 электронов, переходя из степени окисления 0 в +5: $P^0 - 5\bar{e} \rightarrow P^{+5}$
Ответ: $4P + 5O_2 = 2P_2O_5$. В рамке, обозначающей число электронов, следует вписать "5".
б) Реагирует с галогенами:
Фосфор реагирует с галогенами, например, с хлором. В зависимости от условий могут образовываться хлорид фосфора(III) или хлорид фосфора(V). В контексте сильных окислителей (как в пунктах а и в) более вероятным продуктом является хлорид фосфора(V).
Уравнение реакции: $2P + 5Cl_2 = 2PCl_5$
Атом фосфора отдает 5 электронов, переходя из степени окисления 0 в +5: $P^0 - 5\bar{e} \rightarrow P^{+5}$
Ответ: $2P + 5Cl_2 = 2PCl_5$. В рамке следует вписать "5".
в) Реагирует со сложными веществами:
Фосфор реагирует с сильными кислотами-окислителями, такими как концентрированная азотная кислота. Фосфор окисляется до ортофосфорной кислоты, а азот восстанавливается.
Уравнение реакции: $P + 5HNO_3(\text{конц.}) = H_3PO_4 + 5NO_2\uparrow + H_2O$
Составление электронного баланса:
$P^0 - 5\bar{e} \rightarrow P^{+5} \quad | \quad 1 \quad$ (процесс окисления)
$N^{+5} + 1\bar{e} \rightarrow N^{+4} \quad | \quad 5 \quad$ (процесс восстановления)
P (в степени окисления 0) — восстановитель.
$HNO_3$ (за счет N в степени окисления +5) — окислитель.
Ответ: $P + 5HNO_3 = H_3PO_4 + 5NO_2 + H_2O$. Восстановитель - P (фосфор), окислитель - $HNO_3$ (азотная кислота). Процесс окисления: $P^0 - 5\bar{e} \rightarrow P^{+5}$. Процесс восстановления: $N^{+5} + 1\bar{e} \rightarrow N^{+4}$.
2) Окислительные свойства
Реагирует с металлами:
При взаимодействии с активными металлами фосфор проявляет окислительные свойства, принимая электроны и образуя фосфиды.
Уравнение реакции с магнием: $2P + 3Mg = Mg_3P_2$
Атом фосфора принимает 3 электрона, переходя из степени окисления 0 в -3: $P^0 + 3\bar{e} \rightarrow P^{-3}$
Ответ: $2P + 3Mg = Mg_3P_2$. В рамке, обозначающей число электронов, следует вписать "3".
Продукты взаимодействия — фосфиды.
Фосфиды щелочных и щелочноземельных металлов легко разлагаются водой (гидролизуются), при этом образуются два продукта: гидроксид металла и газообразный фосфин. Слово, которое нужно вписать в пустые клетки — фосфин.
Ниже приведены продукты этой реакции:
а)
Гидроксид металла (основание). Например, при гидролизе фосфида магния образуется гидроксид магния: $Mg_3P_2 + 6H_2O \rightarrow 3Mg(OH)_2 + 2PH_3\uparrow$.
Ответ: гидроксид металла.
б)
Фосфин — газообразное соединение фосфора с водородом, имеющее формулу $PH_3$.
Ответ: фосфин ($PH_3$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 82 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 82), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















