Номер 2, страница 92 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §21. Кислородные соединения углерода. Часть 1 - номер 2, страница 92.
№2 (с. 92)
Условие. №2 (с. 92)
скриншот условия
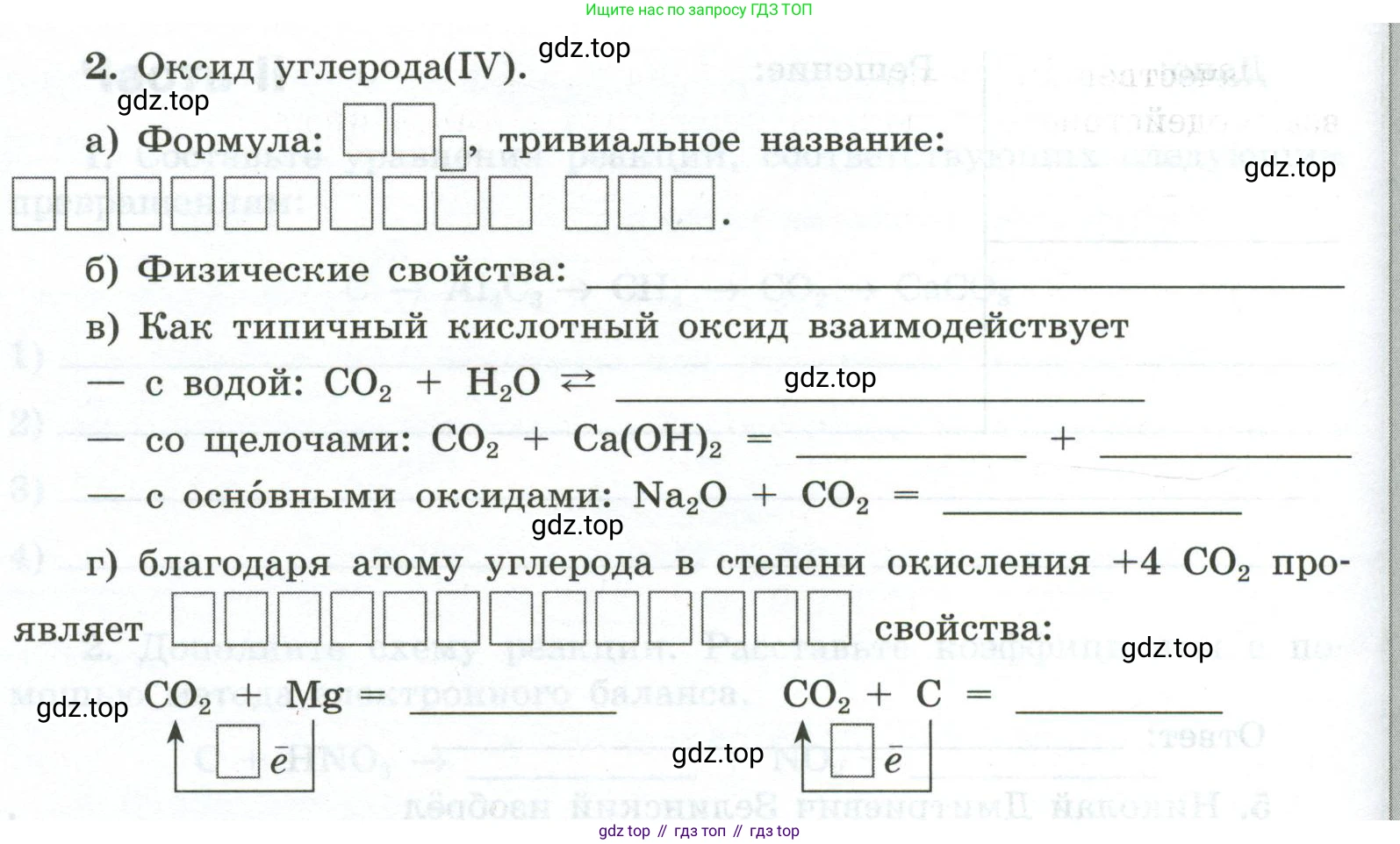
2. Оксид углерода(IV).
а) Формула: , тривиальное название: .
б) Физические свойства:
в) Как типичный кислотный оксид взаимодействует
— с водой: $CO_2 + H_2O \rightleftharpoons \text{ }$
— со щелочами: $CO_2 + Ca(OH)_2 = \text{ } + \text{ }$
— с основными оксидами: $Na_2O + CO_2 = \text{ }$
г) благодаря атому углерода в степени окисления +4 $CO_2$ про-
являет свойства:
$CO_2 + Mg = \text{ }$
$\uparrow \boxed{\quad \bar{e}}$
$CO_2 + C = \text{ }$
$\uparrow \boxed{\quad \bar{e}}$
Решение. №2 (с. 92)

Решение 2. №2 (с. 92)
а) Оксид углерода(IV) указывает на степень окисления углерода +4. Степень окисления кислорода в оксидах, как правило, равна -2. Для того чтобы молекула была электронейтральной, на один атом углерода ($C^{+4}$) должно приходиться два атома кислорода ($O^{-2}$), поэтому химическая формула вещества — $CO_2$. Тривиальное (исторически сложившееся) название этого оксида — углекислый газ.
Ответ: Формула: $CO_2$, тривиальное название: углекислый газ.
б) Оксид углерода(IV), или углекислый газ, при нормальных условиях является бесцветным газом, который не имеет запаха и обладает слегка кисловатым вкусом. Он примерно в 1,5 раза тяжелее воздуха. Растворимость в воде невысокая (при 20°C и нормальном давлении в 1 объёме воды растворяется около 0,9 объёма $CO_2$). Не поддерживает горение. При атмосферном давлении и температуре -78,5 °C $CO_2$ переходит из твёрдого состояния (известного как "сухой лёд") сразу в газообразное, минуя жидкую фазу.
Ответ: Бесцветный газ без запаха, тяжелее воздуха, малорастворим в воде.
в) Являясь типичным кислотным оксидом, оксид углерода(IV) вступает в реакции, характерные для этого класса соединений:
— с водой: При растворении в воде $CO_2$ обратимо реагирует с ней, образуя слабую, нестабильную угольную кислоту $H_2CO_3$. Равновесие этой реакции сильно смещено влево, в сторону исходных веществ.
$CO_2 + H_2O \rightleftharpoons H_2CO_3$
— со щелочами: $CO_2$ реагирует с растворами щелочей (растворимыми основаниями), образуя среднюю или кислую соль и воду. Реакция с гидроксидом кальция $Ca(OH)_2$ (известковой водой) является качественной реакцией на углекислый газ, так как в результате образуется видимый белый осадок карбоната кальция $CaCO_3$.
$CO_2 + Ca(OH)_2 = CaCO_3 \downarrow + H_2O$
— с основными оксидами: $CO_2$ реагирует с оксидами активных металлов (основными оксидами) при сплавлении, образуя соли угольной кислоты — карбонаты.
$Na_2O + CO_2 = Na_2CO_3$
Ответ: $H_2CO_3$; $CaCO_3 \downarrow + H_2O$; $Na_2CO_3$.
г) В молекуле оксида углерода(IV) ($CO_2$) атом углерода находится в своей высшей степени окисления, равной +4. Это означает, что в окислительно-восстановительных реакциях он не может отдавать электроны (то есть окисляться), а может только их принимать (то есть восстанавливаться). Следовательно, $CO_2$ проявляет окислительные свойства.
Он способен окислять сильные восстановители, например, активные металлы (магний) или углерод при высокой температуре.
$CO_2 + 2Mg \xrightarrow{t^{\circ}} 2MgO + C$
В данной реакции углерод восстанавливается от +4 до 0, принимая 4 электрона ($C^{+4} + 4\bar{e} \rightarrow C^0$). Следовательно, в пустой клетке на схеме восстановления $CO_2$ должно быть число 4.
$CO_2 + C \xrightarrow{t^{\circ}} 2CO$
Эта реакция является реакцией сопропорционирования, где углерод в степени окисления 0 ($C$) является восстановителем, а углерод в степени окисления +4 ($CO_2$) — окислителем. Атом углерода-восстановителя окисляется до +2, отдавая 2 электрона ($C^0 - 2\bar{e} \rightarrow C^{+2}$). Следовательно, в пустой клетке на схеме окисления C должно быть число 2.
Ответ: окислительные; $2MgO + C$; 4; $2CO$; 2.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 92 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 92), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















