Номер 3, страница 92 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §21. Кислородные соединения углерода. Часть 1 - номер 3, страница 92.
№3 (с. 92)
Условие. №3 (с. 92)
скриншот условия

3. Получение CO2.
1) В промышленности обжигом известняка:
$CaCO_3 = \text{_______} + \text{_______}$
2) В лаборатории действием кислоты на карбонат кальция (мел, мрамор):
$CaCO_3 + \text{_______} = \text{_______} + \text{_______}$
Решение. №3 (с. 92)
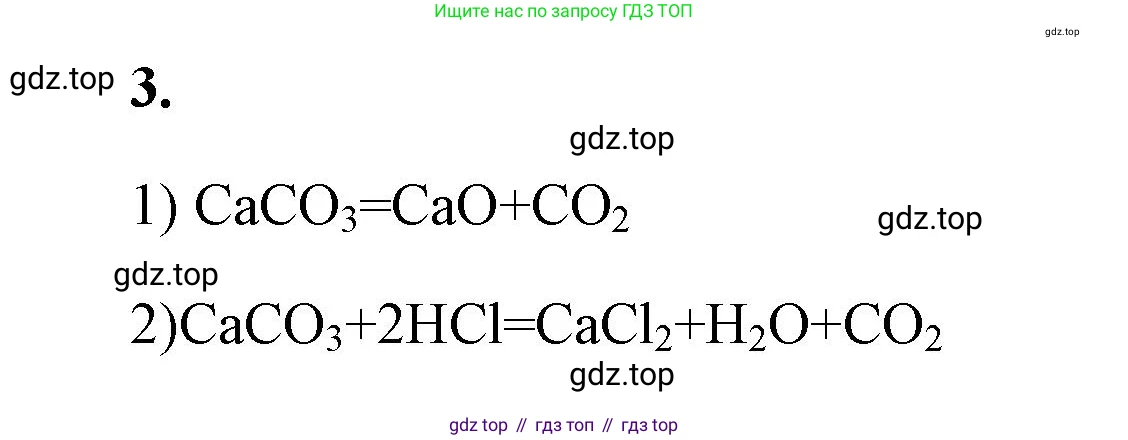
Решение 2. №3 (с. 92)
1) В промышленности обжигом известняка:
Промышленный способ получения углекислого газа ($CO_2$) заключается в термическом разложении (обжиге) известняка, основным компонентом которого является карбонат кальция ($CaCO_3$). При нагревании до высоких температур (около 900 °C) карбонат кальция разлагается на оксид кальция ($CaO$, также известный как негашеная известь) и оксид углерода(IV) ($CO_2$). Уравнение этой реакции выглядит следующим образом:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2$
В этом уравнении слева находится один реагент (карбонат кальция), а справа — два продукта (оксид кальция и углекислый газ).
Ответ: $CaCO_3 = CaO + CO_2$
2) В лаборатории действием кислоты на карбонат кальция (мел, мрамор):
В лабораторных условиях углекислый газ получают в результате реакции обмена между карбонатом кальция ($CaCO_3$) и сильной кислотой, например, соляной кислотой ($HCl$). При их взаимодействии образуется соль (хлорид кальция, $CaCl_2$) и угольная кислота ($H_2CO_3$). Однако угольная кислота является очень неустойчивым соединением и практически мгновенно разлагается на воду ($H_2O$) и углекислый газ ($CO_2$), который выделяется в виде пузырьков. Поэтому итоговое суммарное уравнение реакции записывают с учётом разложения угольной кислоты, и оно включает три продукта. Уравнение реакции, сбалансированное по количеству атомов каждого элемента, имеет вид:
$CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2 \uparrow$
Здесь в качестве реагентов выступают карбонат кальция и соляная кислота, а в качестве продуктов — хлорид кальция, вода и углекислый газ. Знак стрелки вверх ($\uparrow$) указывает на то, что углекислый газ является газообразным веществом и улетучивается из реакционной смеси.
Ответ: $CaCO_3 + 2HCl = CaCl_2 + H_2O + CO_2$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 92 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 92), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















