Номер 7, страница 21 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
3. Повторение и обобщение материала, изученного в 8 классе. Упражнения и задачи для самостоятельного решения - номер 7, страница 21.
№7 (с. 21)
Условие. №7 (с. 21)
скриншот условия

7. Напишите уравнения реакций, соответствующих схеме превращений:
a) металл $\to$ основной оксид $\to$ основание $\to$ соль
б) неметалл $\to$ кислотный оксид $\to$ кислота $\to$ соль
в) металл $\to$ амфотерный оксид $\to$ амфотерный гидроксид $\to$ соль
Решение. №7 (с. 21)

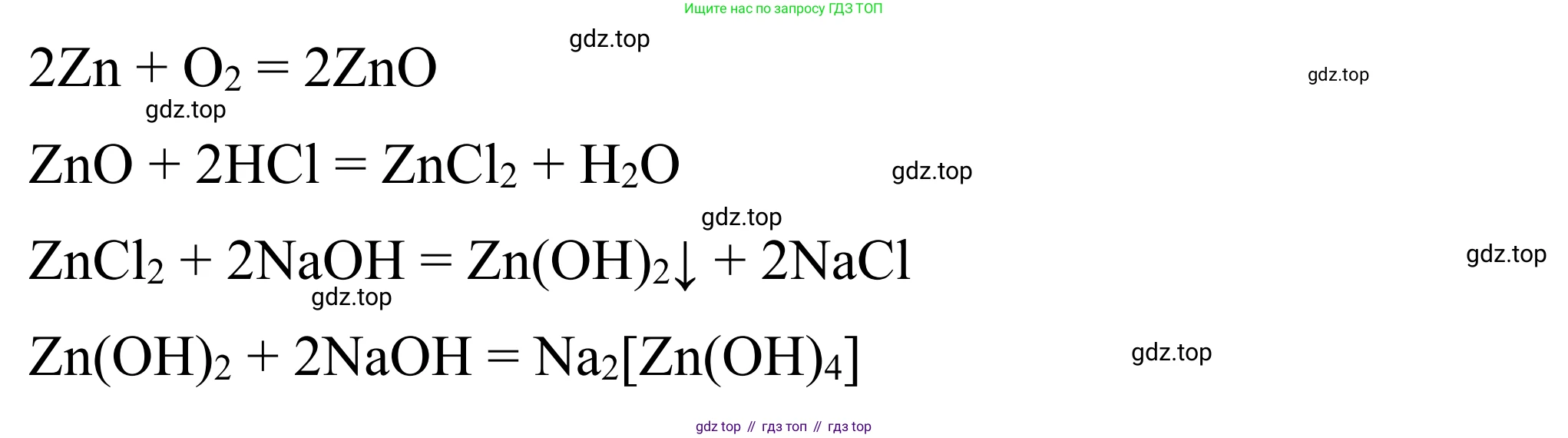
Решение 2. №7 (с. 21)
а) Решение:
Рассмотрим схему превращений: металл → основный оксид → основание → соль. В качестве примера используем щелочноземельный металл кальций ($Ca$).
1. Чтобы получить из металла основный оксид, нужно провести реакцию горения металла в кислороде. В результате образуется оксид кальция:
$2Ca + O_2 \rightarrow 2CaO$
2. Чтобы получить из основного оксида основание, необходимо добавить воды. Оксид кальция активно реагирует с водой, образуя гидроксид кальция (гашёную известь), который является основанием:
$CaO + H_2O \rightarrow Ca(OH)_2$
3. Чтобы получить из основания соль, можно провести реакцию нейтрализации с кислотой. Например, при реакции гидроксида кальция с соляной кислотой образуется соль хлорид кальция и вода:
$Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O$
Ответ:
$2Ca + O_2 \rightarrow 2CaO$
$CaO + H_2O \rightarrow Ca(OH)_2$
$Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O$
б) Решение:
Рассмотрим схему превращений: неметалл → кислотный оксид → кислота → соль. В качестве примера используем неметалл фосфор ($P$).
1. Чтобы получить из неметалла кислотный оксид, проведём реакцию горения фосфора в избытке кислорода. В результате образуется оксид фосфора(V):
$4P + 5O_2 \rightarrow 2P_2O_5$
2. Чтобы получить из кислотного оксида кислоту, необходимо добавить воды. Оксид фосфора(V) реагирует с водой, образуя ортофосфорную кислоту:
$P_2O_5 + 3H_2O \rightarrow 2H_3PO_4$
3. Чтобы получить из кислоты соль, можно провести реакцию с основанием. Например, при реакции ортофосфорной кислоты с гидроксидом калия образуется средняя соль фосфат калия и вода:
$H_3PO_4 + 3KOH \rightarrow K_3PO_4 + 3H_2O$
Ответ:
$4P + 5O_2 \rightarrow 2P_2O_5$
$P_2O_5 + 3H_2O \rightarrow 2H_3PO_4$
$H_3PO_4 + 3KOH \rightarrow K_3PO_4 + 3H_2O$
в) Решение:
Рассмотрим схему превращений: металл → амфотерный оксид → амфотерный гидроксид → соль. В качестве примера используем металл цинк ($Zn$).
1. Чтобы получить из металла амфотерный оксид, проведём реакцию горения цинка в кислороде. В результате образуется оксид цинка, обладающий амфотерными свойствами:
$2Zn + O_2 \rightarrow 2ZnO$
2. Чтобы получить амфотерный гидроксид, нужно учесть, что оксид цинка нерастворим в воде. Поэтому прямой реакцией с водой гидроксид получить нельзя. Превращение осуществляют в две стадии: сначала получают растворимую соль цинка, а затем на нее действуют щелочью.
- Реакция оксида цинка с серной кислотой с образованием соли сульфата цинка:
$ZnO + H_2SO_4 \rightarrow ZnSO_4 + H_2O$
- Реакция сульфата цинка с гидроксидом натрия с образованием нерастворимого гидроксида цинка:
$ZnSO_4 + 2NaOH \rightarrow Zn(OH)_2\downarrow + Na_2SO_4$
3. Чтобы получить из амфотерного гидроксида соль, можно подействовать на него как кислотой, так и щелочью.
- Реакция с кислотой (проявление основных свойств) с образованием соли хлорида цинка:
$Zn(OH)_2 + 2HCl \rightarrow ZnCl_2 + 2H_2O$
- Реакция со щелочью (проявление кислотных свойств) с образованием комплексной соли тетрагидроксоцинката натрия:
$Zn(OH)_2 + 2NaOH \rightarrow Na_2[Zn(OH)_4]$
Ответ:
Пример полной последовательности реакций:
$2Zn + O_2 \rightarrow 2ZnO$
Для второго превращения ($ZnO \rightarrow Zn(OH)_2$):
$ZnO + H_2SO_4 \rightarrow ZnSO_4 + H_2O$
$ZnSO_4 + 2NaOH \rightarrow Zn(OH)_2\downarrow + Na_2SO_4$
Для третьего превращения ($Zn(OH)_2 \rightarrow соль$):
$Zn(OH)_2 + 2HCl \rightarrow ZnCl_2 + 2H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 7 расположенного на странице 21 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 21), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















