Номер 11, страница 22 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
3. Повторение и обобщение материала, изученного в 8 классе. Упражнения и задачи для самостоятельного решения - номер 11, страница 22.
№11 (с. 22)
Условие. №11 (с. 22)
скриншот условия


11. Заполните в тетради таблицу.
Уравнение реакции
Классификационная характеристика реакции:
– по составу реагентов и продуктов
– по изменению степеней окисления
– по обратимости
– по участию катализатора
Разложение известняка:
Взаимодействие растворов нитрата серебра и хлорида натрия:
$AgNO_3 + NaCl \rightarrow AgCl \downarrow + NaNO_3$
Уравнение реакции
Классификационная характеристика реакции:
– по составу реагентов и продуктов
– по изменению степеней окисления
– по обратимости
– по участию катализатора
Взаимодействие железа с раствором сульфата меди(II):
$Fe + CuSO_4 \rightarrow FeSO_4 + Cu$
Взаимодействие порошка алюминия и кристаллического иода:
Разложение пероксида водорода:
$2SO_2 + O_2 \rightarrow 2SO_3$
Взаимодействие азота и водорода:
Решение. №11 (с. 22)

Решение 2. №11 (с. 22)
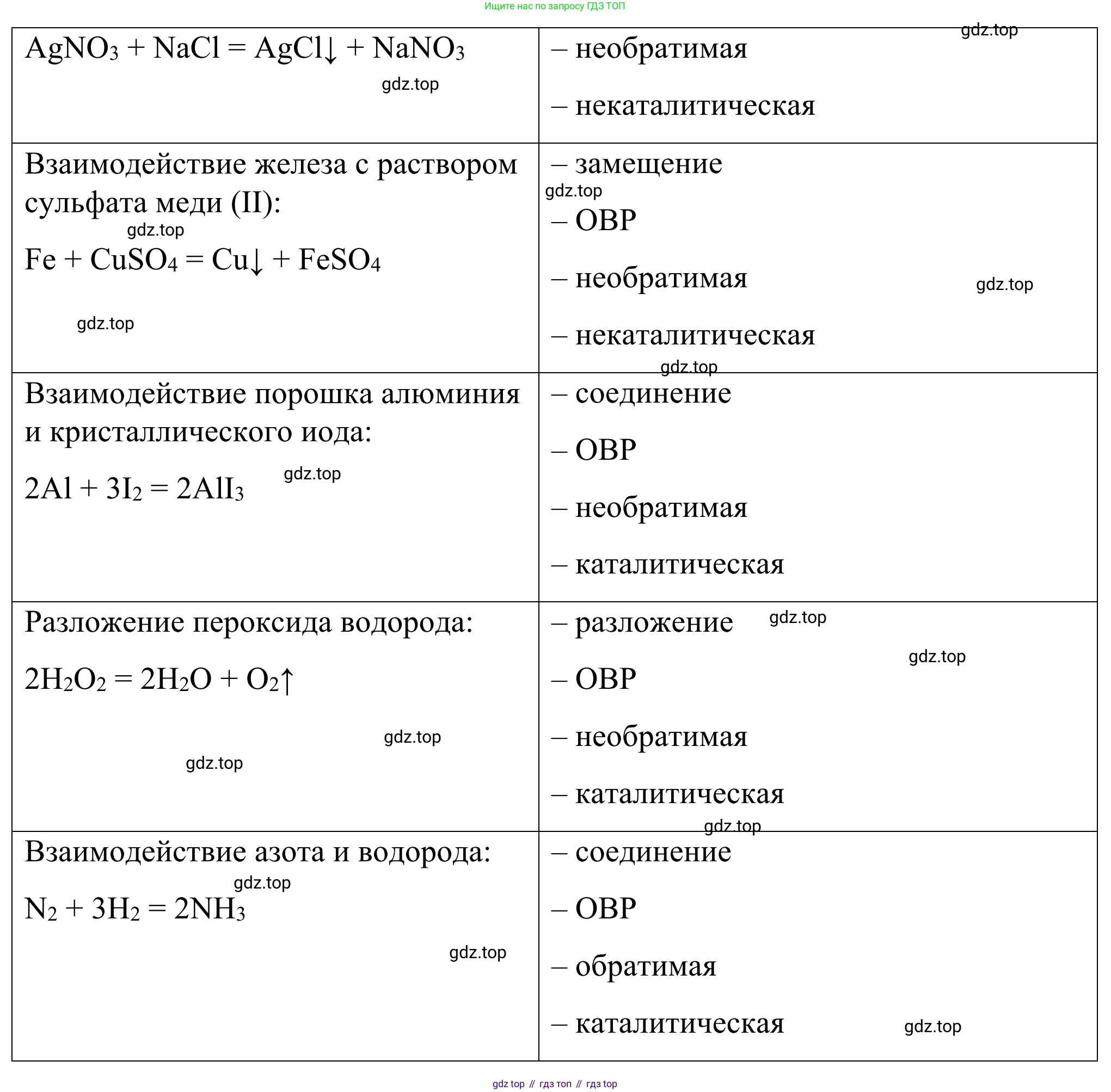
Разложение известняка:
Уравнение реакции: $CaCO_3 \xrightarrow{t^{\circ}} CaO + CO_2$
Классификационная характеристика реакции:
- по составу реагентов и продуктов — реакция разложения (из одного сложного вещества образуются два более простых);
- по изменению степеней окисления — неокислительно-восстановительная (степени окисления элементов не изменяются: $Ca^{+2}C^{+4}O_3^{-2} \rightarrow Ca^{+2}O^{-2} + C^{+4}O_2^{-2}$);
- по обратимости — необратимая (в данных условиях протекает до конца);
- по участию катализатора — некаталитическая (протекает при нагревании без участия катализатора).
Ответ: реакция разложения, неокислительно-восстановительная, необратимая, некаталитическая.
Взаимодействие растворов нитрата серебра и хлорида натрия:
Уравнение реакции: $AgNO_3 + NaCl \rightarrow AgCl\downarrow + NaNO_3$
Классификационная характеристика реакции:
- по составу реагентов и продуктов — реакция обмена (два сложных вещества обмениваются своими составными частями);
- по изменению степеней окисления — неокислительно-восстановительная (степени окисления не изменяются: $Ag^{+1}N^{+5}O_3^{-2} + Na^{+1}Cl^{-1} \rightarrow Ag^{+1}Cl^{-1} + Na^{+1}N^{+5}O_3^{-2}$);
- по обратимости — необратимая (протекает до конца с образованием осадка);
- по участию катализатора — некаталитическая (протекает без катализатора).
Ответ: реакция обмена, неокислительно-восстановительная, необратимая, некаталитическая.
Взаимодействие железа с раствором сульфата меди(II):
Уравнение реакции: $Fe + CuSO_4 \rightarrow FeSO_4 + Cu$
Классификационная характеристика реакции:
- по составу реагентов и продуктов — реакция замещения (атомы простого вещества замещают атомы одного из элементов в сложном веществе);
- по изменению степеней окисления — окислительно-восстановительная (изменяются степени окисления железа и меди: $Fe^0 \rightarrow Fe^{+2}$, $Cu^{+2} \rightarrow Cu^0$);
- по обратимости — необратимая (протекает в одном направлении согласно ряду активности металлов);
- по участию катализатора — некаталитическая (протекает без катализатора).
Ответ: реакция замещения, окислительно-восстановительная, необратимая, некаталитическая.
Взаимодействие порошка алюминия и кристаллического иода:
Уравнение реакции: $2Al + 3I_2 \xrightarrow{H_2O} 2AlI_3$
Классификационная характеристика реакции:
- по составу реагентов и продуктов — реакция соединения (из двух простых веществ образуется одно сложное);
- по изменению степеней окисления — окислительно-восстановительная (изменяются степени окисления алюминия и иода: $Al^0 \rightarrow Al^{+3}$, $I_2^0 \rightarrow 2I^{-1}$);
- по обратимости — необратимая (экзотермическая реакция, протекающая до конца);
- по участию катализатора — каталитическая (катализатором выступает вода).
Ответ: реакция соединения, окислительно-восстановительная, необратимая, каталитическая.
Разложение пероксида водорода:
Уравнение реакции: $2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow$
Классификационная характеристика реакции:
- по составу реагентов и продуктов — реакция разложения (из одного сложного вещества образуются два других);
- по изменению степеней окисления — окислительно-восстановительная (реакция диспропорционирования, кислород изменяет степень окисления: $O^{-1} \rightarrow O^{-2}$ и $O^{-1} \rightarrow O^0$);
- по обратимости — необратимая (протекает до конца, особенно в присутствии катализатора);
- по участию катализатора — каталитическая (ускоряется катализатором, например, оксидом марганца(IV)).
Ответ: реакция разложения, окислительно-восстановительная, необратимая, каталитическая.
Взаимодействие азота и водорода:
Уравнение реакции: $N_2 + 3H_2 \rightleftharpoons 2NH_3$
Классификационная характеристика реакции:
- по составу реагентов и продуктов — реакция соединения (из двух простых веществ образуется одно сложное);
- по изменению степеней окисления — окислительно-восстановительная (изменяются степени окисления азота и водорода: $N_2^0 \rightarrow N^{-3}$, $H_2^0 \rightarrow H^{+1}$);
- по обратимости — обратимая (протекает одновременно в прямом и обратном направлениях);
- по участию катализатора — каталитическая (протекает при высоких температуре и давлении с использованием катализатора).
Ответ: реакция соединения, окислительно-восстановительная, обратимая, каталитическая.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 11 расположенного на странице 22 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №11 (с. 22), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















