Номер 12, страница 77 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
8. Азот, фосфор и их соединения. Упражнения и задачи для самостоятельного решения - номер 12, страница 77.
№12 (с. 77)
Условие. №12 (с. 77)
скриншот условия

12. При горении неизвестного газа в атмосфере хлора образуются азот и хлороводород, причём объёмы хлора и азота находятся в соотношении $3:1$. Определите, что это за газ, напишите уравнение реакции его горения.
Решение. №12 (с. 77)
Решение 2. №12 (с. 77)
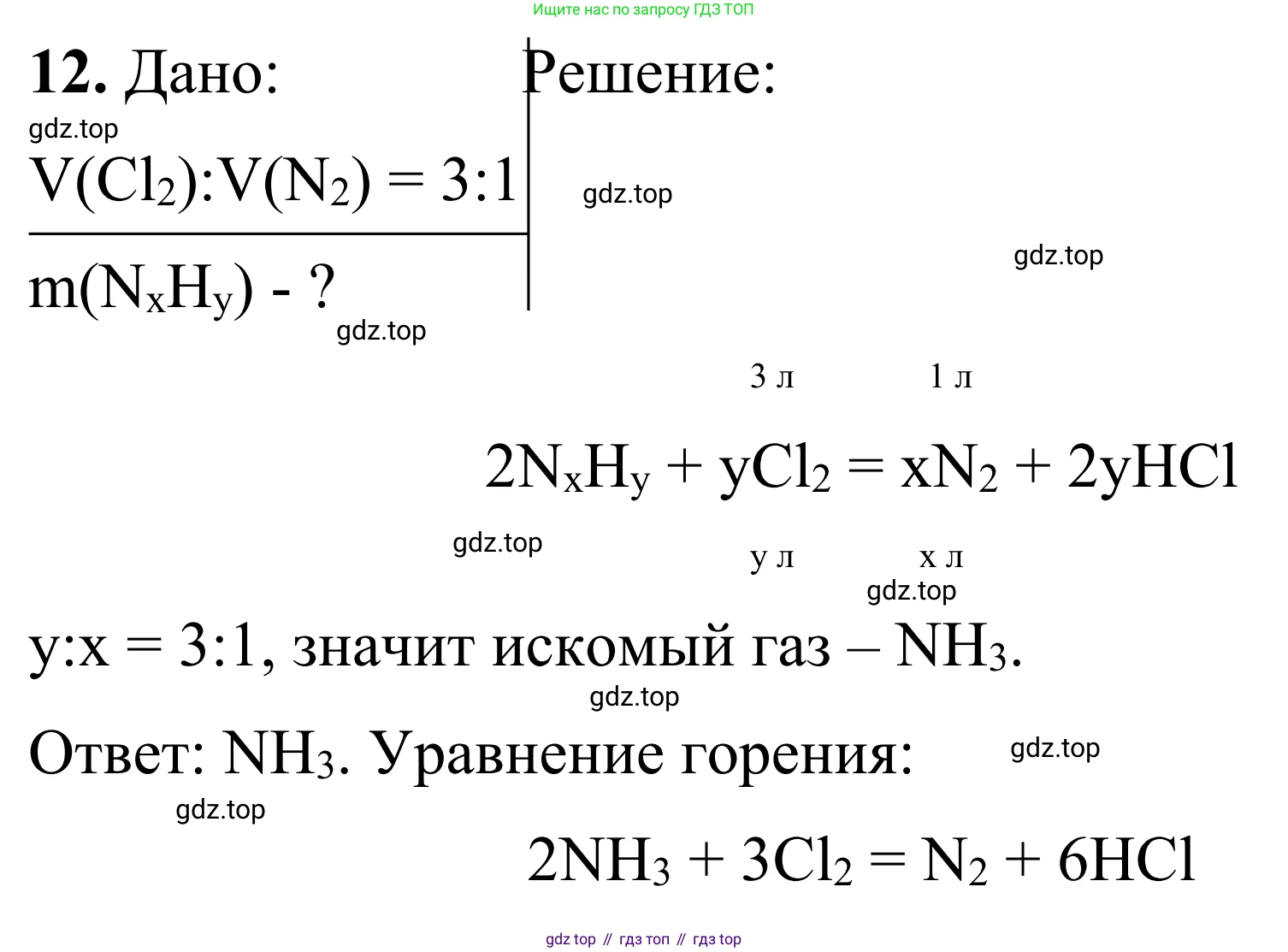
Дано:
Продукты реакции: азот ($N_2$) и хлороводород ($HCl$).
Соотношение объемов: $V(Cl_2) : V(N_2) = 3 : 1$.
Найти:
Определить неизвестный газ и написать уравнение реакции его горения.
Решение:
1. Поскольку в результате реакции образуются азот ($N_2$) и хлороводород ($HCl$), исходный неизвестный газ должен содержать атомы азота (N) и водорода (H). Атом хлора (Cl) в хлороводороде происходит из атмосферы хлора, в которой протекает горение. Обозначим формулу неизвестного газа как $N_xH_y$.
2. Запишем общую схему реакции:
$N_xH_y + Cl_2 \rightarrow N_2 + HCl$
3. Согласно закону Авогадро, для газов при одинаковых условиях (температуре и давлении) соотношение их объемов равно соотношению их количеств вещества (молей). Из условия задачи известно, что $V(Cl_2) : V(N_2) = 3 : 1$, следовательно, мольное соотношение также будет $n(Cl_2) : n(N_2) = 3 : 1$.
4. Это мольное соотношение соответствует стехиометрическим коэффициентам в уравнении реакции. Мы можем подставить эти коэффициенты в нашу схему. Пусть коэффициент перед $N_2$ будет 1, тогда коэффициент перед $Cl_2$ должен быть 3.
$N_xH_y + 3Cl_2 \rightarrow 1N_2 + HCl$
5. Теперь уравняем количество атомов хлора. Слева в $3Cl_2$ находится $3 \times 2 = 6$ атомов хлора. Следовательно, справа должно образоваться 6 молекул $HCl$.
$N_xH_y + 3Cl_2 \rightarrow N_2 + 6HCl$
6. Теперь определим, сколько атомов азота и водорода должно быть в исходном веществе, чтобы уравнение было сбалансировано.
- Справа в продуктах реакции содержится $1 \times 2 = 2$ атома азота и $6 \times 1 = 6$ атомов водорода.
- По закону сохранения массы, столько же атомов должно быть и в левой части уравнения. Все эти атомы происходят из неизвестного газа $N_xH_y$.
7. Таким образом, в исходных реагентах должно быть 2 атома азота и 6 атомов водорода. Это соответствует формуле $N_2H_6$ (диборан - это $B_2H_6$, гидразин - $N_2H_4$) или, что более вероятно для простого газа, двум молекулам вещества с простейшей формулой $NH_3$ (аммиак).
Предположим, что неизвестный газ — это аммиак, $NH_3$. Тогда для баланса атомов нам понадобится 2 молекулы аммиака ($2NH_3$).
8. Подставим $2NH_3$ в уравнение и проверим баланс:
$2NH_3 + 3Cl_2 \rightarrow N_2 + 6HCl$
Проверим количество атомов:
- Азот (N): слева $2 \times 1 = 2$; справа $1 \times 2 = 2$.
- Водород (H): слева $2 \times 3 = 6$; справа $6 \times 1 = 6$.
- Хлор (Cl): слева $3 \times 2 = 6$; справа $6 \times 1 = 6$.
Уравнение полностью сбалансировано, и соотношение объемов $Cl_2$ и $N_2$ (3:1) соблюдается. Следовательно, неизвестный газ — это аммиак.
Ответ:
Неизвестный газ — это аммиак ($NH_3$). Уравнение реакции его горения в хлоре: $2NH_3 + 3Cl_2 \rightarrow N_2 + 6HCl$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 12 расположенного на странице 77 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №12 (с. 77), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















