Номер 8, страница 103 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
10. Металлы. Упражнения и задачи для самостоятельного решения - номер 8, страница 103.
№8 (с. 103)
Условие. №8 (с. 103)
скриншот условия

8. Составьте уравнения электролиза для растворов иодида калия, нитрата серебра, хлорида меди(II), сульфата натрия, серной кислоты.
Решение. №8 (с. 103)
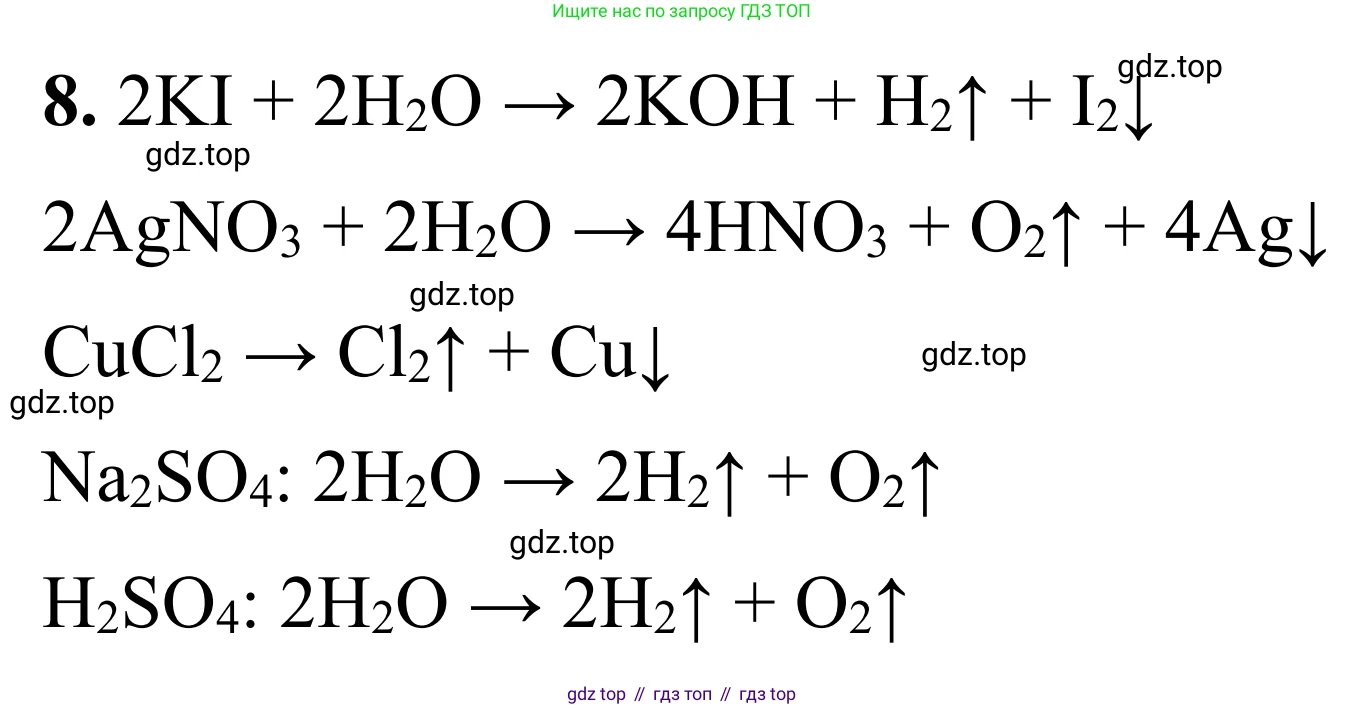
Решение 2. №8 (с. 103)
Решение
иодида калия
Иодид калия ($KI$) является сильным электролитом и в водном растворе диссоциирует на ионы:
$KI \leftrightarrow K^+ + I^-$
Также в растворе присутствуют ионы, образующиеся при диссоциации воды: $H_2O \leftrightarrow H^+ + OH^-$.
На катод (отрицательный электрод) притягиваются катионы $K^+$ и $H^+$, а также полярные молекулы воды. Калий — очень активный металл, поэтому на катоде восстанавливаются молекулы воды:
Катод (-): $2H_2O + 2e^- \rightarrow H_2 \uparrow + 2OH^-$
На анод (положительный электрод) притягиваются анионы $I^-$ и $OH^-$. Иодид-ионы имеют меньший электродный потенциал, чем гидроксид-ионы, и окисляются:
Анод (+): $2I^- - 2e^- \rightarrow I_2$
Ионы $K^+$ и образовавшиеся гидроксид-ионы $OH^-$ накапливаются в растворе, образуя гидроксид калия ($KOH$).
Суммарное уравнение электролиза водного раствора иодида калия:
$2KI + 2H_2O \xrightarrow{\text{электролиз}} 2KOH + H_2 \uparrow + I_2$
Ответ: $2KI + 2H_2O \xrightarrow{\text{электролиз}} 2KOH + H_2 \uparrow (\text{на катоде}) + I_2 (\text{на аноде})$
нитрата серебра
Нитрат серебра ($AgNO_3$) в водном растворе диссоциирует на ионы:
$AgNO_3 \leftrightarrow Ag^+ + NO_3^-$
На катоде конкурируют за восстановление катионы $Ag^+$ и молекулы воды. Серебро — малоактивный металл (стоит после водорода в ряду напряжений), поэтому восстанавливаются ионы серебра:
Катод (-): $Ag^+ + e^- \rightarrow Ag \downarrow$
На аноде конкурируют за окисление нитрат-ионы $NO_3^-$ и молекулы воды. $NO_3^-$ — анион кислородсодержащей кислоты, поэтому он не окисляется, а окисляются молекулы воды:
Анод (+): $2H_2O - 4e^- \rightarrow O_2 \uparrow + 4H^+$
Чтобы уравнять число электронов, умножим катодный процесс на 4. Суммируя процессы на катоде и аноде, получаем:
$4Ag^+ + 2H_2O \rightarrow 4Ag \downarrow + O_2 \uparrow + 4H^+$
Ионы $H^+$ и оставшиеся в растворе нитрат-ионы $NO_3^-$ образуют азотную кислоту ($HNO_3$).
Суммарное молекулярное уравнение:
$4AgNO_3 + 2H_2O \xrightarrow{\text{электролиз}} 4Ag \downarrow + O_2 \uparrow + 4HNO_3$
Ответ: $4AgNO_3 + 2H_2O \xrightarrow{\text{электролиз}} 4Ag \downarrow (\text{на катоде}) + O_2 \uparrow (\text{на аноде}) + 4HNO_3$
хлорида меди(II)
Хлорид меди(II) ($CuCl_2$) в водном растворе диссоциирует на ионы:
$CuCl_2 \leftrightarrow Cu^{2+} + 2Cl^-$
На катоде восстанавливаются ионы меди, так как медь — малоактивный металл:
Катод (-): $Cu^{2+} + 2e^- \rightarrow Cu \downarrow$
На аноде окисляются хлорид-ионы, так как они являются анионами бескислородной кислоты (кроме $F^-$):
Анод (+): $2Cl^- - 2e^- \rightarrow Cl_2 \uparrow$
Число отданных и принятых электронов равно, поэтому суммарное уравнение электролиза представляет собой разложение соли на простые вещества:
$CuCl_2 \xrightarrow{\text{электролиз}} Cu \downarrow + Cl_2 \uparrow$
Ответ: $CuCl_2 \xrightarrow{\text{электролиз}} Cu \downarrow (\text{на катоде}) + Cl_2 \uparrow (\text{на аноде})$
сульфата натрия
Сульфат натрия ($Na_2SO_4$) в водном растворе диссоциирует на ионы:
$Na_2SO_4 \leftrightarrow 2Na^+ + SO_4^{2-}$
На катоде конкурируют ионы $Na^+$ и молекулы воды. Натрий — активный металл, поэтому восстанавливается вода:
Катод (-): $2H_2O + 2e^- \rightarrow H_2 \uparrow + 2OH^-$
На аноде конкурируют ионы $SO_4^{2-}$ и молекулы воды. Сульфат-ион — анион кислородсодержащей кислоты, поэтому окисляется вода:
Анод (+): $2H_2O - 4e^- \rightarrow O_2 \uparrow + 4H^+$
В данном случае электролизу подвергается вода, а сульфат натрия лишь обеспечивает ионную проводимость раствора, не расходуясь.
Суммарное уравнение процесса — это уравнение электролиза воды:
$2H_2O \xrightarrow{Na_2SO_4, \text{ электролиз}} 2H_2 \uparrow + O_2 \uparrow$
Ответ: $2H_2O \xrightarrow{\text{электролиз}} 2H_2 \uparrow (\text{на катоде}) + O_2 \uparrow (\text{на аноде})$
серной кислоты
Серная кислота ($H_2SO_4$) — сильная кислота, в водном растворе диссоциирует:
$H_2SO_4 \leftrightarrow 2H^+ + SO_4^{2-}$
На катоде восстанавливаются ионы водорода $H^+$:
Катод (-): $2H^+ + 2e^- \rightarrow H_2 \uparrow$
На аноде конкурируют сульфат-ионы $SO_4^{2-}$ и молекулы воды. Окисляются молекулы воды:
Анод (+): $2H_2O - 4e^- \rightarrow O_2 \uparrow + 4H^+$
Как и в случае с сульфатом натрия, происходит электролиз воды. Серная кислота является электролитом и не расходуется в ходе реакции (ее концентрация возрастает по мере расходования воды).
Суммарное уравнение процесса:
$2H_2O \xrightarrow{H_2SO_4, \text{ электролиз}} 2H_2 \uparrow + O_2 \uparrow$
Ответ: $2H_2O \xrightarrow{\text{электролиз}} 2H_2 \uparrow (\text{на катоде}) + O_2 \uparrow (\text{на аноде})$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 8 расположенного на странице 103 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 103), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















