Номер 6, страница 114 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
11. Первоначальные представления об органических веществах. Упражнения и задачи для самостоятельного решения - номер 6, страница 114.
№6 (с. 114)
Условие. №6 (с. 114)
скриншот условия

6. Один из основных способов получения предельных углеводородов — переработка синтез-газа (газовой смеси, преимущественно состоящей из угарного газа и водорода). Рассчитайте массовые доли угарного газа и водорода в составе синтез-газа, если их объёмные доли относятся как $1 : 3$ (наличием примесей пренебречь).
Решение. №6 (с. 114)

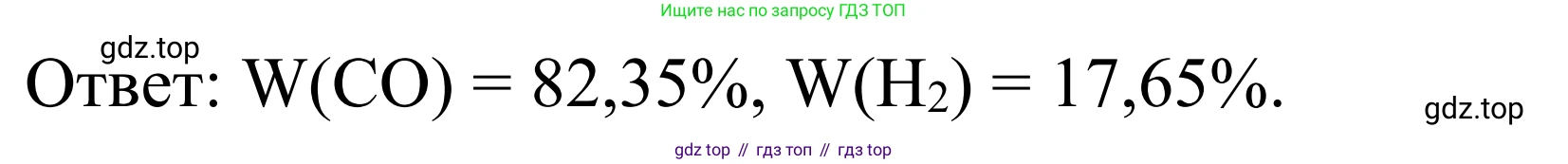
Решение 2. №6 (с. 114)
Дано:
Синтез-газ, состоящий из угарного газа (CO) и водорода (H₂).
Соотношение объёмных долей: $\phi(CO) : \phi(H_2) = 1 : 3$.
Найти:
Массовые доли $\omega(CO)$ и $\omega(H_2)$.
Решение:
Согласно закону Авогадро, для газов при одинаковых условиях (температуре и давлении) соотношение их объёмов равно соотношению количеств вещества (числа молей). Следовательно, соотношение объемных долей равно соотношению мольных долей.
$V(CO) : V(H_2) = n(CO) : n(H_2) = 1 : 3$
Для удобства расчёта примем, что мы имеем дело со смесью, содержащей $n(CO) = 1$ моль угарного газа и $n(H_2) = 3$ моль водорода.
Рассчитаем молярные массы угарного газа и водорода. Используем округленные относительные атомные массы: $Ar(C) = 12$, $Ar(O) = 16$, $Ar(H) = 1$.
$M(CO) = 12 + 16 = 28$ г/моль
$M(H_2) = 2 \cdot 1 = 2$ г/моль
Теперь найдём массы угарного газа и водорода в нашей условной смеси, используя формулу $m = n \cdot M$:
$m(CO) = 1 \text{ моль} \cdot 28 \text{ г/моль} = 28$ г
$m(H_2) = 3 \text{ моль} \cdot 2 \text{ г/моль} = 6$ г
Общая масса смеси составляет сумму масс её компонентов:
$m_{смеси} = m(CO) + m(H_2) = 28 \text{ г} + 6 \text{ г} = 34$ г
Массовая доля ($\omega$) компонента в смеси рассчитывается по формуле:
$\omega(\text{компонента}) = \frac{m(\text{компонента})}{m_{смеси}}$
Рассчитаем массовые доли для каждого компонента:
$\omega(CO) = \frac{m(CO)}{m_{смеси}} = \frac{28}{34} = \frac{14}{17} \approx 0,8235$
$\omega(H_2) = \frac{m(H_2)}{m_{смеси}} = \frac{6}{34} = \frac{3}{17} \approx 0,1765$
Выразим массовые доли в процентах, умножив на 100%:
$\omega(CO) \approx 0,8235 \cdot 100\% = 82,35\%$
$\omega(H_2) \approx 0,1765 \cdot 100\% = 17,65\%$
Ответ: массовая доля угарного газа $\omega(CO) \approx 82,35\%$, массовая доля водорода $\omega(H_2) \approx 17,65\%$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 6 расположенного на странице 114 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 114), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















