Номер 1, страница 114 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
11. Первоначальные представления об органических веществах. Упражнения и задачи для самостоятельного решения - номер 1, страница 114.
№1 (с. 114)
Условие. №1 (с. 114)
скриншот условия

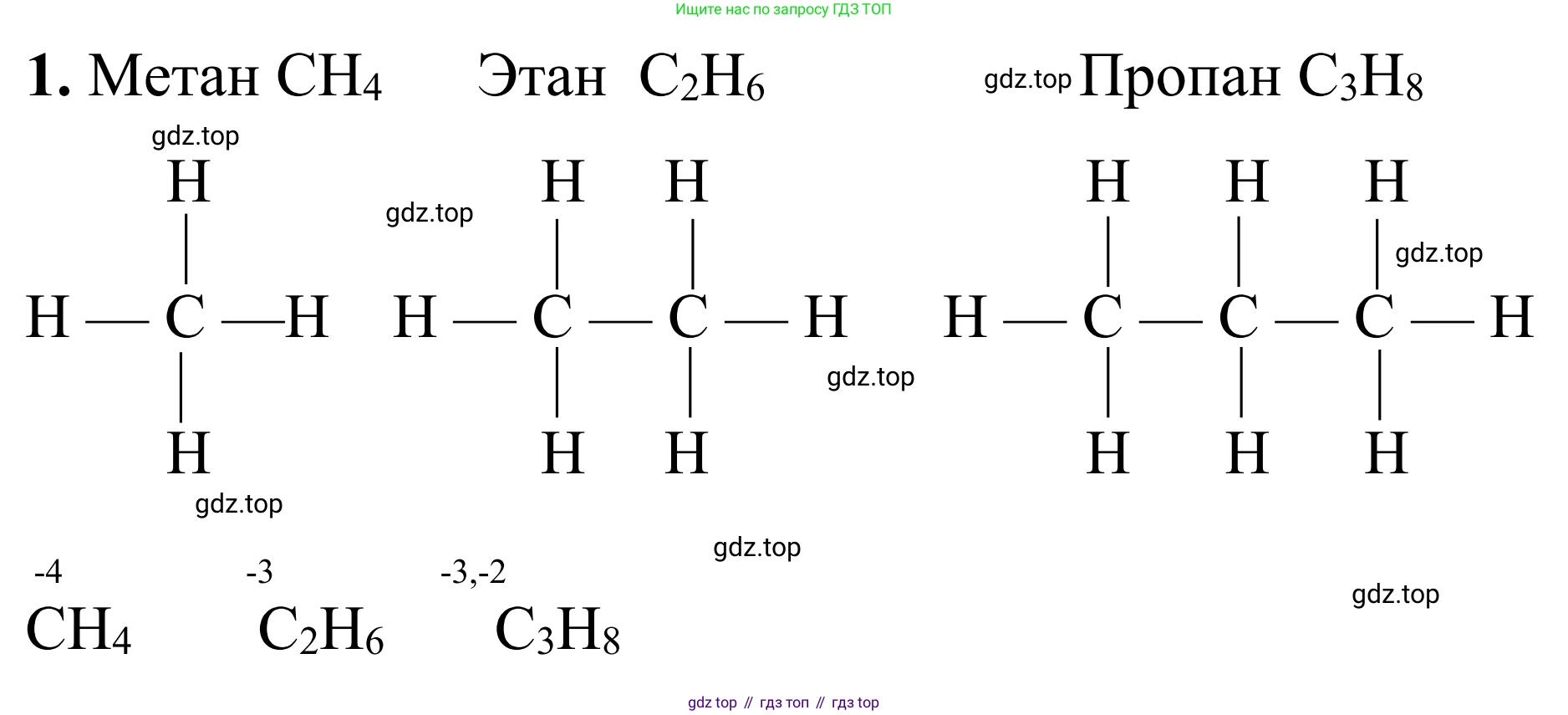
1. Составьте молекулярные и структурные формулы простейших представителей гомологического ряда алканов: метана, этана и пропана. Определите валентность и степень окисления углерода в каждом из этих веществ.
Решение. №1 (с. 114)
Решение 2. №1 (с. 114)
Алканы — это насыщенные углеводороды, в молекулах которых атомы углерода соединены одинарными связями и которые отвечают общей формуле $C_nH_{2n+2}$. Рассмотрим простейших представителей этого гомологического ряда.
Метан
Молекулярная формула метана (n=1) — $CH_4$.
Структурная формула метана:
H | H-C-H | H
Валентность углерода — это число ковалентных связей, которые образует атом. В метане атом углерода образует четыре одинарные связи с атомами водорода, следовательно, его валентность равна IV.
Степень окисления — это условный заряд атома в молекуле, вычисленный из предположения, что все связи являются ионными. В соединениях с водородом степень окисления водорода принимается за +1. Поскольку молекула $CH_4$ электронейтральна, сумма степеней окисления всех атомов равна нулю. Пусть степень окисления углерода равна $x$:
$x + 4 \cdot (+1) = 0$
$x = -4$
Ответ: Молекулярная формула — $CH_4$. Валентность углерода — IV. Степень окисления углерода — -4.
Этан
Молекулярная формула этана (n=2) — $C_2H_6$.
Структурная формула этана:
H H | | H-C - C-H | | H H
Каждый атом углерода в этане образует четыре одинарные связи (три с водородом и одну с другим атомом углерода), поэтому валентность углерода равна IV.
В молекуле этана оба атома углерода находятся в одинаковом химическом окружении, поэтому их степени окисления равны. Рассчитаем степень окисления углерода ($x$), приняв степень окисления водорода за +1:
$2 \cdot x + 6 \cdot (+1) = 0$
$2x = -6$
$x = -3$
Ответ: Молекулярная формула — $C_2H_6$. Валентность углерода — IV. Степень окисления углерода — -3.
Пропан
Молекулярная формула пропана (n=3) — $C_3H_8$.
Структурная формула пропана:
H H H | | | H-C - C - C-H | | | H H H
Каждый атом углерода в пропане образует четыре одинарные связи, следовательно, валентность углерода равна IV.
В молекуле пропана атомы углерода находятся в разном химическом окружении: два крайних (в метильных группах $-CH_3$) и один центральный (в метиленовой группе $-CH_2-$). Поэтому их степени окисления будут различаться. При расчете исходим из того, что связь C-C не влияет на степень окисления, а каждая связь C-H изменяет степень окисления углерода на -1 (так как углерод более электроотрицателен, чем водород).
• Степень окисления крайних атомов углерода (C1 и C3): каждый атом связан с тремя атомами H. Их степень окисления равна -3.
• Степень окисления центрального атома углерода (C2): он связан с двумя атомами H. Его степень окисления равна -2.
Проверка: общая сумма степеней окисления в молекуле должна быть равна нулю: $2 \cdot (-3) + 1 \cdot (-2) + 8 \cdot (+1) = -6 - 2 + 8 = 0$.
Ответ: Молекулярная формула — $C_3H_8$. Валентность углерода — IV. Степени окисления углерода: -3 для крайних атомов и -2 для центрального.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 114 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 114), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















