Номер 4, страница 12 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Реакция нейтрализации. Лабораторный опыт 2 - номер 4, страница 12.
№4 (с. 12)
Условие. №4 (с. 12)
скриншот условия
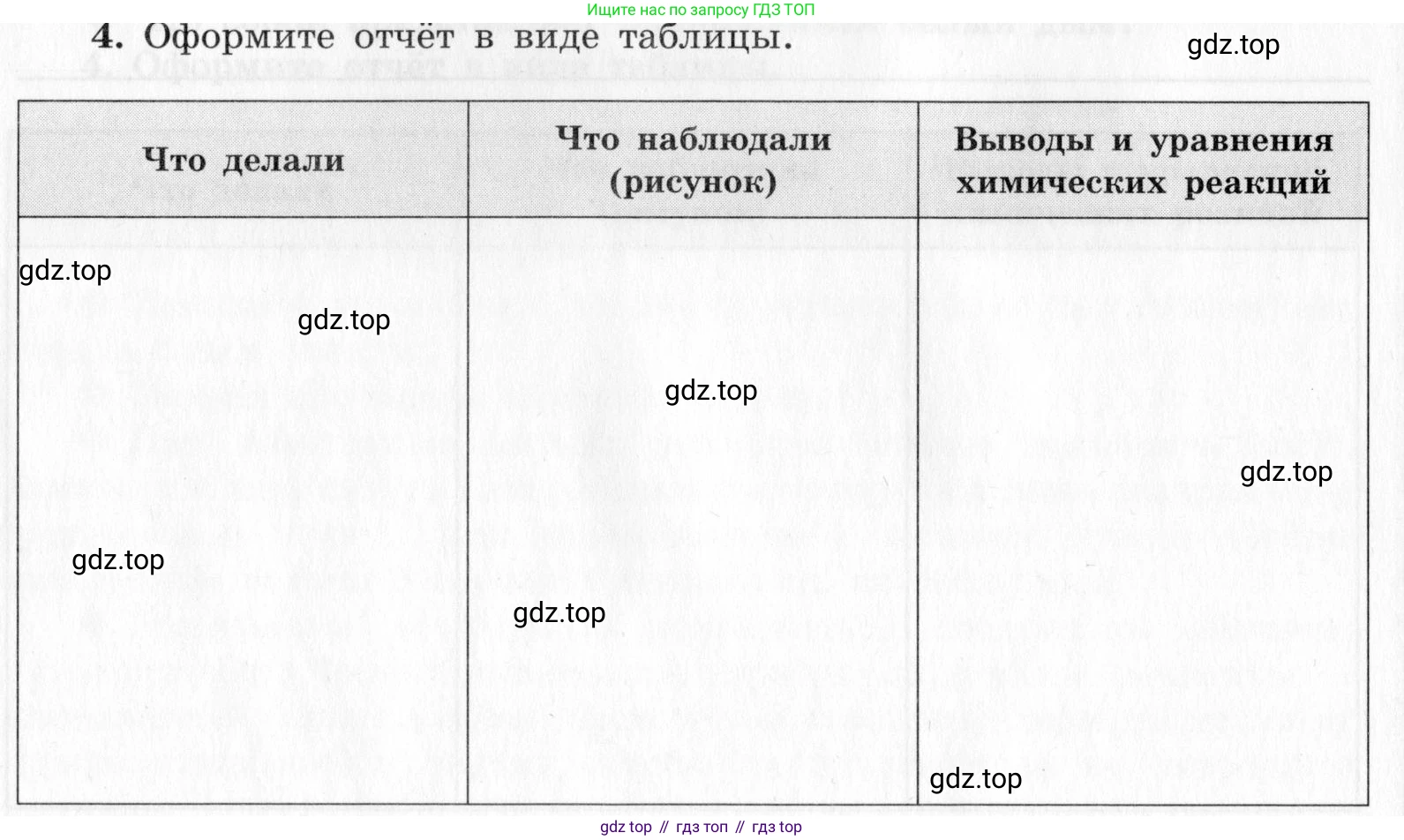
4. Оформите отчёт в виде таблицы.
| Что делали | Что наблюдали (рисунок) | Выводы и уравнения химических реакций |
|---|---|---|
Решение. №4 (с. 12)

Решение 2. №4 (с. 12)
Представляем отчет в виде последовательного описания содержимого, которое могло бы быть размещено в таблице, согласно заданным столбцам для нескольких типичных лабораторных экспериментов.
Эксперимент 1: Взаимодействие цинка с соляной кислотой
Что делали
В чистую пробирку поместили одну гранулу металлического цинка. Затем осторожно добавили в пробирку 2-3 мл разбавленного раствора соляной кислоты.
Ответ: Поместили гранулу цинка в пробирку, добавили 2-3 мл раствора соляной кислоты.
Что наблюдали (рисунок)
На поверхности гранулы цинка сразу же началось бурное выделение бесцветного газа в виде пузырьков. Гранула цинка постепенно уменьшалась в размерах, растворяясь. Наблюдалось легкое нагревание пробирки.
Ответ: Наблюдалось бурное выделение бесцветного газа и растворение цинка; пробирка слегка нагрелась.
Выводы и уравнения химических реакций
Произошла реакция замещения, в результате которой цинк вытеснил водород из кислоты. Выделившийся газ – водород. Реакция является экзотермической.
Уравнение реакции: $Zn_{(тв)} + 2HCl_{(р-р)} \to ZnCl_{2(р-р)} + H_{2(г)}\uparrow$
Полное ионное уравнение: $Zn_{(тв)} + 2H^+_{(р-р)} + 2Cl^-_{(р-р)} \to Zn^{2+}_{(р-р)} + 2Cl^-_{(р-р)} + H_{2(г)}\uparrow$
Сокращенное ионное уравнение: $Zn_{(тв)} + 2H^+_{(р-р)} \to Zn^{2+}_{(р-р)} + H_{2(г)}\uparrow$
Ответ: Произошла реакция замещения с образованием водорода. Уравнения реакций приведены выше.
Эксперимент 2: Взаимодействие сульфата меди(II) с гидроксидом натрия
Что делали
В пробирку налили 2-3 мл раствора сульфата меди(II) ($CuSO_4$). Затем по каплям добавили к нему раствор гидроксида натрия ($NaOH$).
Ответ: В пробирку с раствором $CuSO_4$ добавили раствор $NaOH$.
Что наблюдали (рисунок)
При добавлении раствора гидроксида натрия наблюдалось образование ярко-синего студенистого осадка. Раствор над осадком стал бесцветным.
Ответ: Образовался синий студенистый осадок, раствор стал бесцветным.
Выводы и уравнения химических реакций
Произошла реакция ионного обмена между растворимой солью и растворимым основанием, в результате которой образовался нерастворимый гидроксид меди(II) – синий осадок.
Уравнение реакции: $CuSO_{4(р-р)} + 2NaOH_{(р-р)} \to Cu(OH)_{2(тв)}\downarrow + Na_2SO_{4(р-р)}$
Полное ионное уравнение: $Cu^{2+}_{(р-р)} + SO_4^{2-}_{(р-р)} + 2Na^+_{(р-р)} + 2OH^-_{(р-р)} \to Cu(OH)_{2(тв)}\downarrow + 2Na^+_{(р-р)} + SO_4^{2-}_{(р-р)}$
Сокращенное ионное уравнение: $Cu^{2+}_{(р-р)} + 2OH^-_{(р-р)} \to Cu(OH)_{2(тв)}\downarrow$
Ответ: Произошла реакция ионного обмена с образованием осадка гидроксида меди(II). Уравнения реакций приведены выше.
Эксперимент 3: Взаимодействие карбоната натрия с соляной кислотой
Что делали
В пробирку поместили небольшое количество твердого карбоната натрия ($Na_2CO_3$). Затем добавили 2-3 мл раствора соляной кислоты ($HCl$).
Ответ: В пробирку с твердым $Na_2CO_3$ добавили раствор $HCl$.
Что наблюдали (рисунок)
Наблюдалось бурное выделение бесцветного газа без запаха. Твердый карбонат натрия постепенно растворялся.
Ответ: Наблюдалось бурное выделение бесцветного газа и растворение карбоната натрия.
Выводы и уравнения химических реакций
Произошла реакция ионного обмена, в результате которой образовалась неустойчивая угольная кислота ($H_2CO_3$), которая сразу же разложилась на воду и углекислый газ ($CO_2$).
Уравнение реакции: $Na_2CO_{3(тв)} + 2HCl_{(р-р)} \to 2NaCl_{(р-р)} + H_2O_{(ж)} + CO_{2(г)}\uparrow$
Полное ионное уравнение: $2Na^+_{(тв)} + CO_3^{2-}_{(тв)} + 2H^+_{(р-р)} + 2Cl^-_{(р-р)} \to 2Na^+_{(р-р)} + 2Cl^-_{(р-р)} + H_2O_{(ж)} + CO_{2(г)}\uparrow$
Сокращенное ионное уравнение: $CO_3^{2-}_{(тв)} + 2H^+_{(р-р)} \to H_2O_{(ж)} + CO_{2(г)}\uparrow$
Ответ: Произошла реакция ионного обмена с выделением углекислого газа. Уравнения реакций приведены выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 12 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 12), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















