Практическая работа 1, страница 16 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 1. Классификация химических реакций. Параграф 4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость - страница 16.
Практическая работа 1 (с. 16)
Условие. Практическая работа 1 (с. 16)
скриншот условия

● Какие правила техники безопасности нужно соблюдать при работе с кислотами и пероксидом водорода?
1. Влияние природы реагирующих веществ1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее?
2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
2. Влияние концентрации реагирующих веществВ две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30%-ной соляной кислоты, в другую — 1 мл 10%-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
3. Влияние поверхности соприкосновения реагентовВ одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
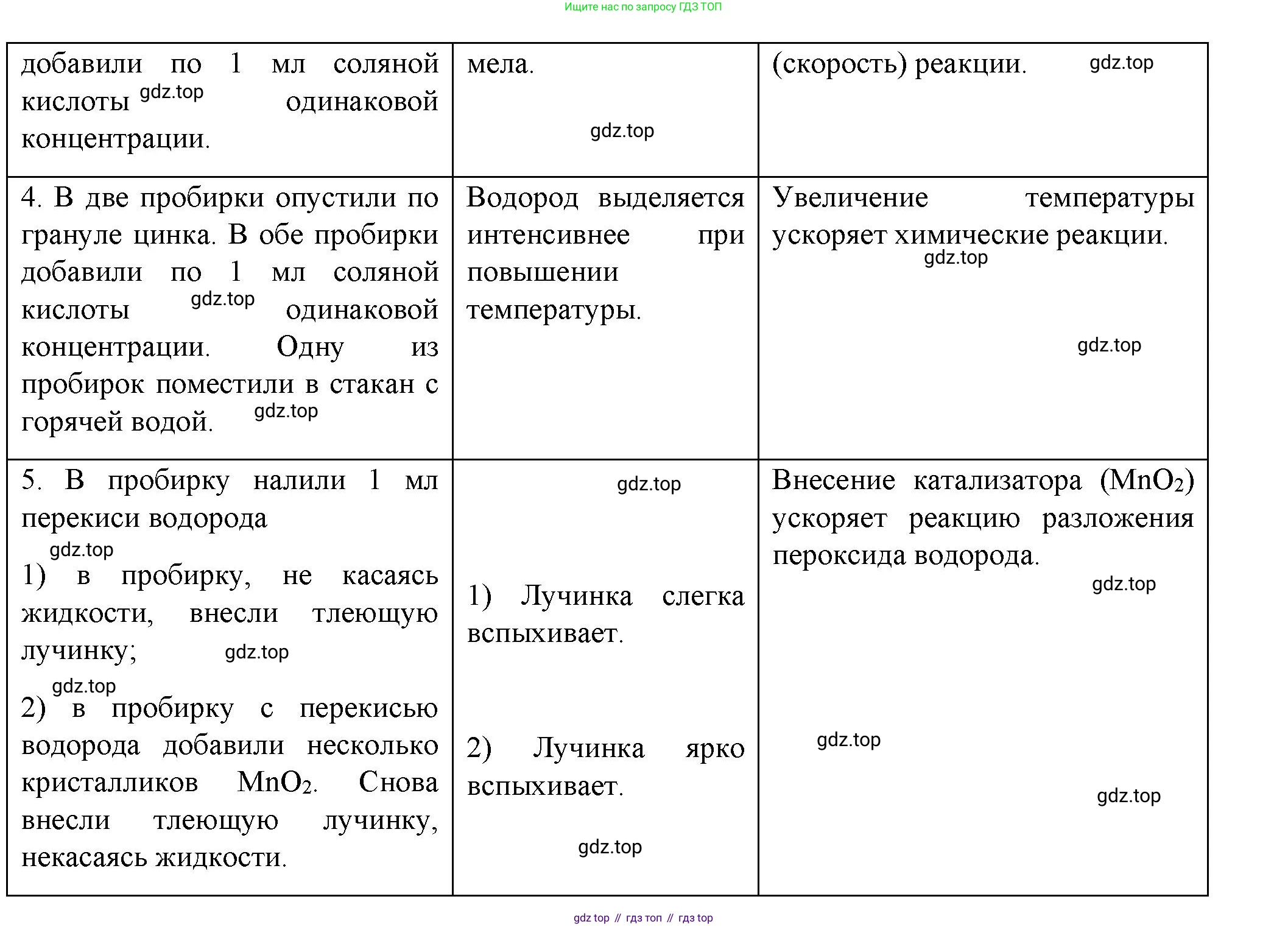
4. Влияние температурыВ две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
5. Влияние катализатораВ пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца(IV) $MnO_2$ и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет $MnO_2$?
6. Отчёт о работе составьте в произвольной форме и сделайте общий вывод. Личный результатЯ знаю, какие факторы влияют на скорость химической реакции.
Решение. Практическая работа 1 (с. 16)


Решение 2. Практическая работа 1 (с. 16)
Какие правила техники безопасности нужно соблюдать при работе с кислотами и пероксидом водорода?
При работе с кислотами и пероксидом водорода необходимо соблюдать следующие правила техники безопасности:
- Всегда надевать защитные очки для предотвращения попадания брызг в глаза.
- Использовать защитный халат и перчатки для защиты кожи и одежды.
- Работу с концентрированными кислотами и пероксидом водорода проводить в вытяжном шкафу.
- При разбавлении кислот, необходимо медленно приливать кислоту к воде, а не наоборот, чтобы избежать бурного вскипания и разбрызгивания.
- Избегать контакта химических веществ с кожей и слизистыми оболочками. В случае попадания, немедленно промыть пораженный участок большим количеством воды.
- Не допускать смешивания концентрированного пероксида водорода с горючими веществами, так как он является сильным окислителем и может вызвать воспламенение.
- Пробирки с реагирующими веществами нельзя закрывать пробкой, особенно если реакция идет с выделением газа. Отверстие пробирки следует направлять в сторону от себя и от других людей.
Ответ: Необходимо использовать средства индивидуальной защиты (очки, халат, перчатки), работать в проветриваемом помещении или под тягой, правильно разбавлять кислоты (кислоту в воду) и избегать контакта реагентов с кожей и слизистыми.
1. Влияние природы реагирующих веществ
1)
Наблюдения:
- В первой пробирке с магнием ($Mg$) наблюдается очень бурная реакция с соляной кислотой ($HCl$), происходит интенсивное выделение пузырьков газа (водорода). Пробирка заметно нагревается.
- Во второй пробирке с цинком ($Zn$) реакция протекает менее активно, чем с магнием, но также наблюдается равномерное выделение пузырьков газа.
- В третьей пробирке с медью ($Cu$) видимых признаков реакции не наблюдается.
Какая из реакций протекает быстрее?
Самая быстрая реакция — взаимодействие магния с соляной кислотой. Это объясняется тем, что скорость реакции зависит от химической активности металла. В ряду активности металлов магний стоит левее цинка, а цинк — левее водорода. Медь стоит правее водорода, поэтому она не вытесняет его из соляной кислоты.
Уравнения реакций:
$Mg + 2HCl \rightarrow MgCl_2 + H_2 \uparrow$
$Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
$Cu + HCl \rightarrow \text{реакция не идет}$
Ответ: Быстрее всего протекает реакция магния с соляной кислотой. В пробирке с медью реакция не идет.
2)
Наблюдения:
В обеих пробирках с гранулами цинка наблюдается выделение газа, однако в пробирке с соляной кислотой ($HCl$) реакция протекает значительно быстрее и интенсивнее, чем в пробирке с уксусной кислотой ($CH_3COOH$).
Определение, какая реакция протекает быстрее:
Реакция цинка с соляной кислотой протекает быстрее. Соляная кислота является сильной кислотой и в водном растворе практически полностью диссоциирует на ионы $H^+$ и $Cl^-$. Уксусная кислота — слабая, она диссоциирует лишь частично. Следовательно, при одинаковой молярной концентрации кислот, концентрация ионов водорода $H^+$, непосредственно реагирующих с цинком, в растворе соляной кислоты намного выше. Чем выше концентрация реагирующих веществ, тем выше скорость реакции.
Ответ: Реакция с соляной кислотой протекает быстрее, так как соляная кислота — сильная, и концентрация ионов водорода в ней выше, чем в слабой уксусной кислоте той же концентрации.
2. Влияние концентрации реагирующих веществ
Где более интенсивно проходит реакция? Почему?
Реакция более интенсивно проходит в пробирке с 30%-ной соляной кислотой. Скорость химической реакции напрямую зависит от концентрации реагирующих веществ. В 30%-ном растворе концентрация молекул $HCl$ (и, соответственно, ионов $H^+$) выше, чем в 10%-ном. Это приводит к увеличению числа столкновений частиц цинка и ионов водорода в единицу времени, что и вызывает более высокую скорость реакции.
Ответ: Реакция интенсивнее в пробирке с 30%-ной соляной кислотой, так как скорость реакции возрастает с увеличением концентрации реагентов.
3. Влияние поверхности соприкосновения реагентов
Есть ли разница в скорости выделения газа?
Да, разница есть. В пробирке, куда насыпали порошок мела ($CaCO_3$), реакция с соляной кислотой ($HCl$) протекает гораздо быстрее и бурнее, чем в пробирке с кусочком мела. Это проявляется в более интенсивном выделении углекислого газа ($CO_2$).
Это объясняется тем, что у порошка значительно больше площадь поверхности соприкосновения с кислотой по сравнению с целым куском. Чем больше площадь поверхности твердого реагента, тем больше частиц могут одновременно вступать в реакцию, что и увеличивает её скорость.
Уравнение реакции: $CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$
Ответ: Да, есть. Порошок мела реагирует значительно быстрее, чем кусок, так как у порошка больше площадь поверхности соприкосновения.
4. Влияние температуры
Сравнение интенсивности и вывод:
В пробирке, помещенной в стакан с горячей водой, выделение пузырьков водорода происходит значительно интенсивнее, чем в пробирке, находящейся при комнатной температуре. Это свидетельствует о том, что скорость реакции цинка с соляной кислотой в горячей воде выше.
Вывод: Повышение температуры приводит к увеличению скорости химической реакции. Это происходит потому, что при нагревании увеличивается кинетическая энергия частиц. Они начинают двигаться быстрее, что приводит к увеличению частоты их столкновений. Кроме того, возрастает доля "эффективных" столкновений, то есть тех, которые обладают достаточной энергией для преодоления энергетического барьера реакции (активационной энергии).
Ответ: В горячей воде реакция идет быстрее. Вывод: скорость химической реакции увеличивается с повышением температуры.
5. Влияние катализатора
Наблюдения и роль $MnO_2$:
- При внесении тлеющей лучинки в пробирку с пероксидом водорода ($H_2O_2$) ничего не происходит. Это говорит о том, что без катализатора разложение пероксида водорода при комнатной температуре протекает очень медленно, и кислород практически не выделяется.
- После добавления кристалликов оксида марганца(IV) ($MnO_2$) начинается бурное выделение газа (вспенивание). Если в этот момент снова внести тлеющую лучинку, она ярко вспыхивает. Это доказывает, что выделяющийся газ — кислород.
Роль $MnO_2$: Оксид марганца(IV) играет роль катализатора. Катализатор — это вещество, которое ускоряет химическую реакцию, но само при этом не расходуется. $MnO_2$ предоставляет альтернативный путь реакции с более низкой энергией активации, что и приводит к резкому увеличению скорости разложения пероксида водорода.
Уравнение реакции: $2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2 \uparrow$
Ответ: Без $MnO_2$ реакция не идет, с $MnO_2$ — бурно выделяется газ, зажигающий тлеющую лучинку. $MnO_2$ является катализатором реакции разложения пероксида водорода.
6. Отчёт о работе составьте в произвольной форме и сделайте общий вывод.
В ходе проделанной работы было экспериментально исследовано влияние различных факторов на скорость химических реакций.
- Было установлено, что скорость реакции зависит от природы реагирующих веществ. Активные металлы (магний) реагируют с кислотами быстрее, чем менее активные (цинк), а сильные кислоты (соляная) реагируют быстрее, чем слабые (уксусная).
- Было показано, что скорость реакции зависит от концентрации: 30%-ная соляная кислота реагирует с цинком быстрее, чем 10%-ная.
- Было определено, что для гетерогенных реакций важна площадь поверхности соприкосновения реагентов. Порошок мела реагирует с кислотой значительно быстрее, чем кусок мела.
- Было продемонстрировано влияние температуры: при нагревании реакция цинка с кислотой значительно ускоряется.
- Была изучена роль катализатора: оксид марганца(IV) резко ускоряет реакцию разложения пероксида водорода, сам при этом не расходуясь.
Общий вывод:
Скорость химической реакции является величиной, которая зависит от множества факторов, включая природу и концентрацию реагентов, температуру, площадь поверхности соприкосновения (для гетерогенных систем) и наличие катализаторов. Управляя этими факторами, можно изменять скорость протекания химических процессов в желаемую сторону.
Ответ: Скорость химической реакции зависит от природы и концентрации реагентов, температуры, площади их соприкосновения и наличия катализатора.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Практическая работа 1 расположенного на странице 16 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа 1 (с. 16), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















