Номер 2, страница 18 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 1. Классификация химических реакций. Параграф 5. Обратимые реакции. Понятие о химическом равновесии. Подумай, ответь, выполни... - номер 2, страница 18.
№2 (с. 18)
Условие. №2 (с. 18)
скриншот условия

2. Определите, в каком направлении сместится равновесие:
а) при увеличении концентрации одного из исходных веществ;
б) при повышении температуры;
в) при повышении давления в следующих реакциях:
$2SO_2 + O_2 \rightleftharpoons 2SO_3 + Q$
$N_2 + 3H_2 \rightleftharpoons 2NH_3 + Q$
$N_2 + O_2 \rightleftharpoons 2NO - Q$
Решение. №2 (с. 18)
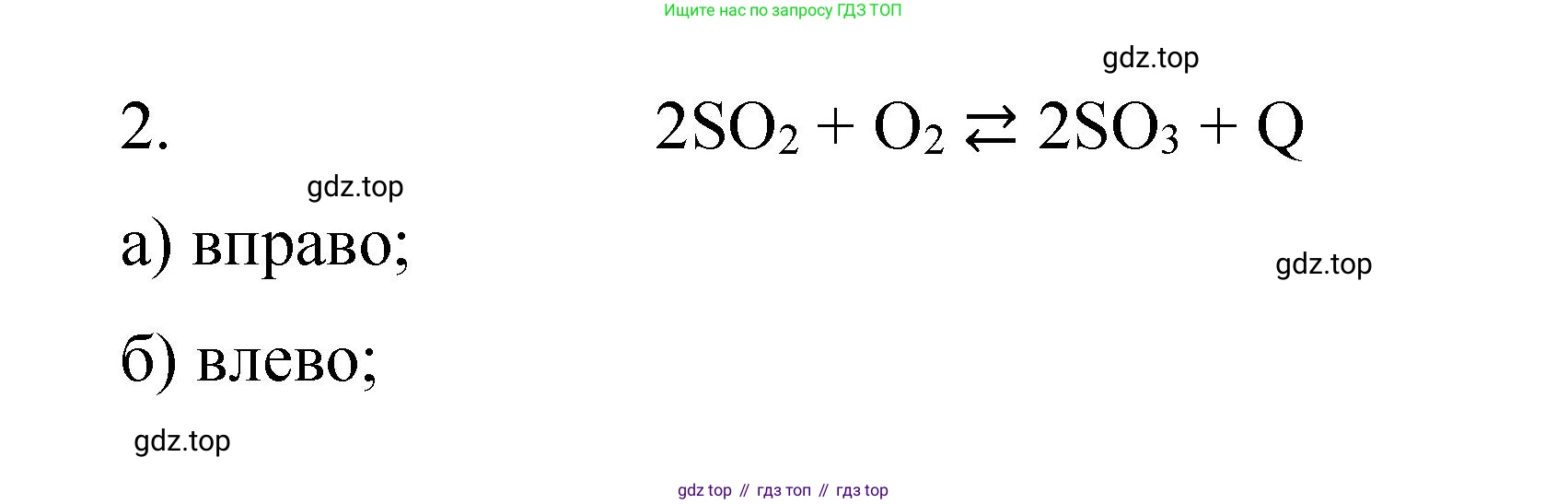

Решение 2. №2 (с. 18)
Для решения данной задачи воспользуемся принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие сместится в том направлении, которое ослабляет это воздействие.
1. Реакция: $2SO_2 + O_2 \rightleftharpoons 2SO_3 + Q$ (реакция экзотермическая)
а) при увеличении концентрации одного из исходных веществ
При увеличении концентрации $SO_2$ или $O_2$ система будет стремиться их израсходовать. Следовательно, равновесие сместится в сторону прямой реакции, то есть в сторону образования продукта $SO_3$.
Ответ: Равновесие сместится вправо.
б) при повышении температуры
Прямая реакция является экзотермической (выделяется теплота, $+Q$). Согласно принципу Ле Шателье, при повышении температуры равновесие смещается в сторону эндотермической (поглощающей тепло) реакции, которой в данном случае является обратная реакция разложения $SO_3$.
Ответ: Равновесие сместится влево.
в) при повышении давления
При повышении давления равновесие смещается в сторону меньшего количества молей газообразных веществ. В левой части уравнения реакции (исходные вещества) находится $2 + 1 = 3$ моль газа. В правой части (продукты) — $2$ моль газа. Так как $2 < 3$, равновесие сместится в сторону образования продуктов.
Ответ: Равновесие сместится вправо.
2. Реакция: $N_2 + 3H_2 \rightleftharpoons 2NH_3 + Q$ (реакция экзотермическая)
а) при увеличении концентрации одного из исходных веществ
При увеличении концентрации $N_2$ или $H_2$ равновесие сместится в сторону их расходования, то есть в сторону прямой реакции синтеза аммиака $NH_3$.
Ответ: Равновесие сместится вправо.
б) при повышении температуры
Прямая реакция является экзотермической ($+Q$). Повышение температуры сместит равновесие в сторону обратной, эндотермической реакции.
Ответ: Равновесие сместится влево.
в) при повышении давления
В левой части уравнения $1 + 3 = 4$ моль газов, а в правой — $2$ моль. При повышении давления равновесие смещается в сторону меньшего числа молей, то есть в сторону образования $NH_3$.
Ответ: Равновесие сместится вправо.
3. Реакция: $N_2 + O_2 \rightleftharpoons 2NO - Q$ (реакция эндотермическая)
а) при увеличении концентрации одного из исходных веществ
При увеличении концентрации $N_2$ или $O_2$ равновесие сместится в сторону прямой реакции для их компенсации.
Ответ: Равновесие сместится вправо.
б) при повышении температуры
Прямая реакция является эндотермической (поглощается теплота, $-Q$). Повышение температуры будет способствовать протеканию эндотермической реакции, то есть прямой реакции.
Ответ: Равновесие сместится вправо.
в) при повышении давления
В левой части уравнения $1 + 1 = 2$ моль газов. В правой части также $2$ моль газов. Поскольку количество молей газообразных веществ в ходе реакции не изменяется, изменение давления не влияет на положение равновесия.
Ответ: Равновесие не сместится.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 18 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 18), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















