Лабораторный опыт, страница 34 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химические реакции в водных растворах. Параграф 9. Реакции ионного обмена. Вопросы в начале параграфа - страница 34.
Лабораторный опыт (с. 34)
Условие. Лабораторный опыт (с. 34)
скриншот условия

Лабораторный опыт. Реакции между растворами электролитов
1) В пробирку с раствором хлорида натрия прилейте раствор нитрата серебра(I) или нитрата свинца(II). Выпадает осадок.
2) В пробирку с раствором карбоната натрия прилейте соляной кислоты. В результате реакции выделяется газ.
3) В пробирку с раствором азотной кислоты прилейте раствор гидроксида калия. В результате реакции выделяется теплота.
4) К раствору хлорида магния прилейте раствор сульфата натрия. Признаков химической реакции не наблюдается.
● Запишите уравнения проведённых реакций.
Решение. Лабораторный опыт (с. 34)

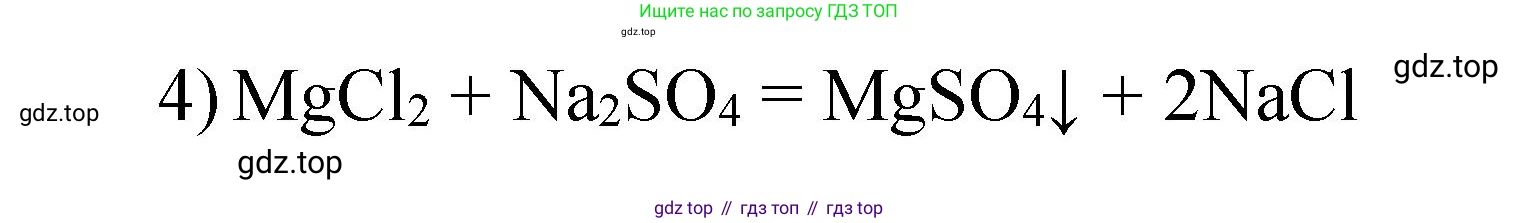
Решение 2. Лабораторный опыт (с. 34)
1) В пробирку с раствором хлорида натрия прилейте раствор нитрата серебра(I) или нитрата свинца(II). Выпадает осадок.
В данном пункте описаны две возможные качественные реакции на хлорид-ион, обе являются реакциями ионного обмена и приводят к образованию нерастворимого осадка.
Вариант 1: с нитратом серебра(I). При взаимодействии хлорида натрия с нитратом серебра(I) образуется белый творожистый осадок хлорида серебра(I).
Молекулярное уравнение реакции:
$NaCl + AgNO_3 \rightarrow AgCl \downarrow + NaNO_3$
Полное ионное уравнение:
$Na^+ + Cl^- + Ag^+ + NO_3^- \rightarrow AgCl \downarrow + Na^+ + NO_3^-$
Сокращенное ионное уравнение:
$Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Вариант 2: с нитратом свинца(II). При взаимодействии хлорида натрия с нитратом свинца(II) образуется белый кристаллический осадок хлорида свинца(II).
Молекулярное уравнение реакции:
$2NaCl + Pb(NO_3)_2 \rightarrow PbCl_2 \downarrow + 2NaNO_3$
Полное ионное уравнение:
$2Na^+ + 2Cl^- + Pb^{2+} + 2NO_3^- \rightarrow PbCl_2 \downarrow + 2Na^+ + 2NO_3^-$
Сокращенное ионное уравнение:
$Pb^{2+} + 2Cl^- \rightarrow PbCl_2 \downarrow$
Ответ: $NaCl + AgNO_3 \rightarrow AgCl \downarrow + NaNO_3$ или $2NaCl + Pb(NO_3)_2 \rightarrow PbCl_2 \downarrow + 2NaNO_3$.
2) В пробирку с раствором карбоната натрия прилейте соляной кислоты. В результате реакции выделяется газ.
При взаимодействии раствора карбоната натрия (соль, образованная слабой кислотой) с сильной соляной кислотой происходит реакция обмена. В ходе реакции образуется очень слабая и неустойчивая угольная кислота ($H_2CO_3$), которая тут же разлагается на углекислый газ ($CO_2$) и воду ($H_2O$). Выделение пузырьков газа является видимым признаком реакции.
Молекулярное уравнение реакции:
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2 \uparrow$
Полное ионное уравнение:
$2Na^+ + CO_3^{2-} + 2H^+ + 2Cl^- \rightarrow 2Na^+ + 2Cl^- + H_2O + CO_2 \uparrow$
Сокращенное ионное уравнение:
$2H^+ + CO_3^{2-} \rightarrow H_2O + CO_2 \uparrow$
Ответ: $Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2 \uparrow$.
3) В пробирку с раствором азотной кислоты прилейте раствор гидроксида калия. В результате реакции выделяется теплота.
Происходит реакция нейтрализации между сильной азотной кислотой ($HNO_3$) и сильным основанием — гидроксидом калия ($KOH$). Реакции нейтрализации всегда экзотермичны, что и наблюдается в виде выделения теплоты. Продуктами являются соль (нитрат калия) и вода.
Молекулярное уравнение реакции:
$HNO_3 + KOH \rightarrow KNO_3 + H_2O$
Полное ионное уравнение:
$H^+ + NO_3^- + K^+ + OH^- \rightarrow K^+ + NO_3^- + H_2O$
Сокращенное ионное уравнение, отражающее суть всех реакций нейтрализации между сильными кислотами и основаниями:
$H^+ + OH^- \rightarrow H_2O$
Ответ: $HNO_3 + KOH \rightarrow KNO_3 + H_2O$.
4) К раствору хлорида магния прилейте раствор сульфата натрия. Признаков химической реакции не наблюдается.
Реакции ионного обмена в растворах идут до конца, если образуется осадок, газ или слабый электролит (например, вода). В данном случае исходные вещества, хлорид магния ($MgCl_2$) и сульфат натрия ($Na_2SO_4$), являются растворимыми солями. Посмотрим на возможные продукты реакции обмена: сульфат магния ($MgSO_4$) и хлорид натрия ($NaCl$).
Согласно таблице растворимости, оба предполагаемых продукта также хорошо растворимы в воде. Таким образом, в растворе просто смешиваются ионы $Mg^{2+}$, $Cl^-$, $Na^+$ и $SO_4^{2-}$, но образования новых веществ не происходит. Реакция не идет.
$MgCl_2 + Na_2SO_4 \nrightarrow$
Ответ: Химическая реакция не протекает, так как в результате не образуется ни осадка, ни газа, ни слабого электролита.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Лабораторный опыт расположенного на странице 34 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Лабораторный опыт (с. 34), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















