Номер 2, страница 64 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 4. Кислород и сера. Параграф 17. Характеристика кислорода и серы. Подумай, ответь, выполни... - номер 2, страница 64.
№2 (с. 64)
Условие. №2 (с. 64)
скриншот условия

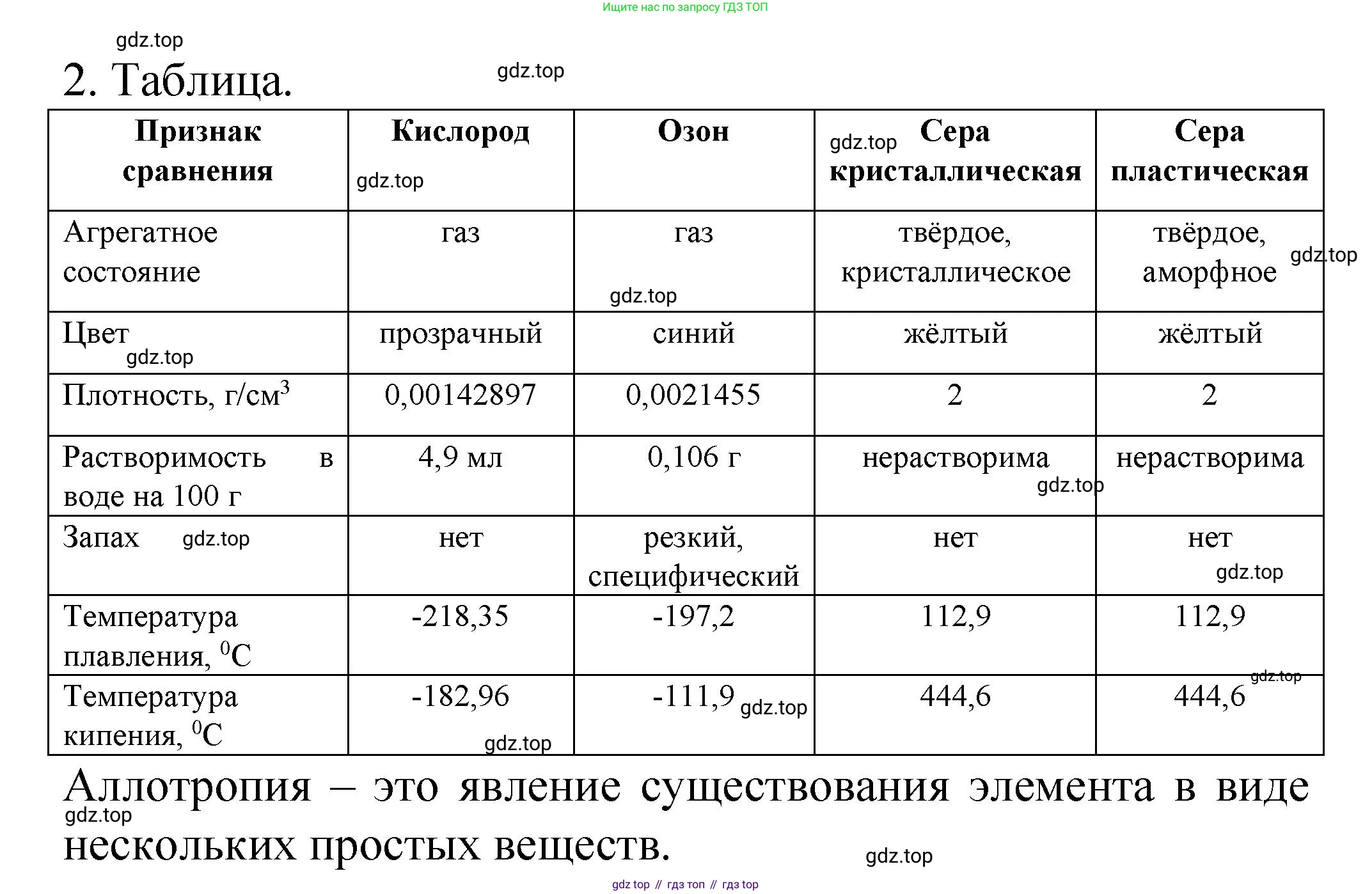
2. Сравните свойства кислорода и озона, кристаллической и пласти-ческой серы. На этих примерах поясните сущность явления аллотропии.
Решение. №2 (с. 64)
Решение 2. №2 (с. 64)
Сравнение свойств кислорода и озона
Кислород и озон являются аллотропными модификациями химического элемента кислорода (O).
- Кислород ($O_2$):
- Состав и строение: Молекула состоит из двух атомов кислорода, связанных прочной двойной ковалентной связью.
- Физические свойства: Газ без цвета, вкуса и запаха. Плохо растворим в воде. Температура кипения $-183$ °C.
- Химические свойства: Сильный окислитель, но менее активный, чем озон. Поддерживает горение и необходим для дыхания большинства живых организмов. Относительно устойчив.
- Озон ($O_3$):
- Состав и строение: Молекула состоит из трех атомов кислорода.
- Физические свойства: Газ бледно-голубого цвета с резким, характерным запахом (запах "свежести" после грозы). Растворим в воде лучше, чем кислород. Температура кипения $-112$ °C.
- Химические свойства: Очень сильный окислитель, значительно более активный, чем кислород. Неустойчив и самопроизвольно разлагается на кислород: $2O_3 \rightarrow 3O_2$. В больших концентрациях ядовит.
Основное различие между кислородом и озоном заключается в количестве атомов в их молекулах. Это различие в строении приводит к существенным различиям в их физических (цвет, запах, температура кипения) и химических (окислительная активность, стабильность) свойствах.
Ответ: Кислород ($O_2$) и озон ($O_3$) — это аллотропные модификации элемента кислорода, различающиеся числом атомов в молекуле (два и три соответственно). Это различие обусловливает их разные физические (кислород — бесцветный газ без запаха, озон — бледно-голубой газ с резким запахом) и химические (озон — значительно более сильный окислитель и менее стабилен) свойства.
Сравнение свойств кристаллической и пластической серы
Кристаллическая (ромбическая) и пластическая сера являются аллотропными модификациями химического элемента серы (S).
- Кристаллическая сера ($S_8$):
- Состав и строение: Состоит из циклических молекул $S_8$, имеющих форму короны. Эти молекулы упакованы в упорядоченную ромбическую кристаллическую решетку.
- Физические свойства: Твердое вещество желтого цвета, хрупкое. Нерастворима в воде, но хорошо растворима в сероуглероде ($CS_2$). Является наиболее устойчивой модификацией серы при комнатной температуре.
- Пластическая сера:
- Состав и строение: Является аморфной формой серы. Образуется при быстром охлаждении расплавленной серы. Состоит из длинных полимерных цепей атомов серы ($S_n$), которые хаотично переплетены. Не имеет кристаллической структуры.
- Физические свойства: Резиноподобное, эластичное вещество коричневатого цвета. Нерастворима ни в воде, ни в сероуглероде. Эта форма неустойчива (метастабильна) и со временем самопроизвольно превращается обратно в устойчивую кристаллическую серу.
Различие между кристаллической и пластической серой заключается в строении простого вещества: в первом случае это упорядоченная структура из отдельных молекул-колец ($S_8$), а во втором — хаотичная структура из длинных атомных цепей. Это различие в строении определяет их разные физические свойства (хрупкость/эластичность, цвет, растворимость, устойчивость).
Ответ: Кристаллическая и пластическая сера — это аллотропные модификации элемента серы, различающиеся строением. Кристаллическая сера состоит из упорядоченно расположенных циклических молекул $S_8$ и является хрупким кристаллическим веществом. Пластическая сера состоит из длинных неупорядоченных полимерных цепей атомов серы и является эластичным аморфным веществом.
Сущность явления аллотропии
Аллотропия — это способность химического элемента существовать в виде двух или нескольких простых веществ, различных по строению и свойствам. Эти простые вещества называются аллотропными модификациями или аллотропами.
Причина аллотропии заключается в том, что атомы одного и того же элемента могут соединяться друг с другом по-разному, образуя структуры, которые отличаются:
- Числом атомов в молекуле. Пример: кислород ($O_2$) и озон ($O_3$). Молекулы этих веществ состоят из разного числа атомов элемента кислорода, что и определяет их различные свойства.
- Строением кристаллической решетки или формой молекул. Пример: сера. Кристаллическая сера состоит из молекул $S_8$, уложенных в кристаллическую решетку, в то время как пластическая сера состоит из длинных полимерных цепей атомов. Другими примерами являются алмаз и графит (аллотропы углерода), которые различаются типом кристаллической решетки.
Таким образом, рассмотренные примеры наглядно показывают, что один и тот же химический элемент может образовывать простые вещества с совершенно разными свойствами, если атомы этого элемента по-разному соединены или организованы в пространстве.
Ответ: Сущность явления аллотропии состоит в способности одного химического элемента образовывать несколько простых веществ (аллотропных модификаций), отличающихся по строению и, следовательно, по свойствам. Это различие в строении может быть обусловлено либо разным числом атомов в молекуле (как у кислорода $O_2$ и озона $O_3$), либо разным взаимным расположением атомов и строением кристаллической решетки (как у кристаллической и пластической серы).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 64 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 64), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















