Номер 8, страница 34 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава II. Предельные углеводороды — алканы. Параграф 8. Гомологи и изомеры алканов. Подумайте, ответьте, выполните... - номер 8, страница 34.
№8 (с. 34)
Условие. №8 (с. 34)
скриншот условия

8. При сжигании 8,6 г углеводорода получили 26,4 г оксида углерода(IV) и 12,6 г воды. Найдите молекулярную формулу этого углеводорода, если его плотность по отношению к воздуху равна 2,966. Напишите структурные формулы всех изомеров этого углеводорода и назовите эти изомеры.
Решение. №8 (с. 34)

Решение 2. №8 (с. 34)
Дано:
$m(C_xH_y) = 8,6$ г
$m(CO_2) = 26,4$ г
$m(H_2O) = 12,6$ г
$D_{воздух}(C_xH_y) = 2,966$
$M_{воздуха} \approx 29$ г/моль
$M(C) = 12$ г/моль
$M(H) = 1$ г/моль
$M(O) = 16$ г/моль
Найти:
1. Молекулярную формулу углеводорода $C_xH_y$.
2. Структурные формулы и названия всех его изомеров.
Решение:
1. Нахождение молекулярной формулы углеводорода.
Общее уравнение сгорания углеводорода имеет вид:
$C_xH_y + (x + y/4)O_2 \rightarrow xCO_2 + (y/2)H_2O$
Сначала найдем количество вещества (моль) продуктов сгорания — оксида углерода(IV) и воды. Для этого нам понадобятся их молярные массы.
Молярная масса оксида углерода(IV) ($CO_2$):
$M(CO_2) = 12 + 2 \cdot 16 = 44$ г/моль.
Молярная масса воды ($H_2O$):
$M(H_2O) = 2 \cdot 1 + 16 = 18$ г/моль.
Количество вещества $CO_2$:
$n(CO_2) = \frac{m(CO_2)}{M(CO_2)} = \frac{26,4 \text{ г}}{44 \text{ г/моль}} = 0,6$ моль.
Количество вещества $H_2O$:
$n(H_2O) = \frac{m(H_2O)}{M(H_2O)} = \frac{12,6 \text{ г}}{18 \text{ г/моль}} = 0,7$ моль.
Весь углерод из сгоревшего углеводорода перешел в $CO_2$, а весь водород — в $H_2O$. Найдем количество вещества атомов углерода и водорода в исходном соединении.
$n(C) = n(CO_2) = 0,6$ моль.
$n(H) = 2 \cdot n(H_2O) = 2 \cdot 0,7 \text{ моль} = 1,4$ моль.
Найдем массы углерода и водорода в исходном веществе:
$m(C) = n(C) \cdot M(C) = 0,6 \text{ моль} \cdot 12 \text{ г/моль} = 7,2$ г.
$m(H) = n(H) \cdot M(H) = 1,4 \text{ моль} \cdot 1 \text{ г/моль} = 1,4$ г.
Проверим, есть ли в веществе другие элементы, сравнив сумму масс C и H с исходной массой углеводорода:
$m(C) + m(H) = 7,2 \text{ г} + 1,4 \text{ г} = 8,6$ г.
Эта масса равна исходной массе углеводорода (8,6 г), следовательно, вещество состоит только из углерода и водорода.
Далее найдем простейшую (эмпирическую) формулу углеводорода. Для этого найдем соотношение индексов $x$ и $y$ как соотношение количеств веществ атомов:
$x : y = n(C) : n(H) = 0,6 : 1,4$
Чтобы получить целочисленное соотношение, разделим оба числа на наименьшее (0,6):
$x : y = \frac{0,6}{0,6} : \frac{1,4}{0,6} = 1 : 2,333... = 1 : \frac{7}{3}$
Умножим на 3, чтобы получить целые числа:
$x : y = 3 : 7$
Простейшая формула углеводорода: $C_3H_7$.
Теперь найдем истинную (молекулярную) формулу. Для этого вычислим молярную массу углеводорода, используя его относительную плотность по воздуху.
$D_{воздух}(C_xH_y) = \frac{M(C_xH_y)}{M_{воздуха}}$
$M(C_xH_y) = D_{воздух}(C_xH_y) \cdot M_{воздуха} = 2,966 \cdot 29 \text{ г/моль} \approx 86$ г/моль.
Вычислим молярную массу вещества с простейшей формулой $C_3H_7$:
$M(C_3H_7) = 3 \cdot 12 + 7 \cdot 1 = 43$ г/моль.
Сравним истинную молярную массу с молярной массой простейшей формулы, чтобы найти, во сколько раз молекулярная формула "больше" эмпирической:
$\frac{M(C_xH_y)}{M(C_3H_7)} = \frac{86 \text{ г/моль}}{43 \text{ г/моль}} = 2$
Следовательно, истинная молекулярная формула содержит в 2 раза больше атомов, чем простейшая.
Молекулярная формула: $(C_3H_7)_2 = C_6H_{14}$. Это гексан.
2. Структурные формулы и названия изомеров $C_6H_{14}$.
Найденная формула $C_6H_{14}$ соответствует общей формуле насыщенных углеводородов (алканов) $C_nH_{2n+2}$ (где $n=6, 2n+2 = 14$). Для гексана существует 5 структурных изомеров:
1. Гексан (н-гексан):
$CH_3-CH_2-CH_2-CH_2-CH_2-CH_3$
2. 2-метилпентан (изогексан):
$CH_3-CH(CH_3)-CH_2-CH_2-CH_3$
3. 3-метилпентан:
$CH_3-CH_2-CH(CH_3)-CH_2-CH_3$
4. 2,2-диметилбутан (неогексан):
$CH_3-C(CH_3)_2-CH_2-CH_3$
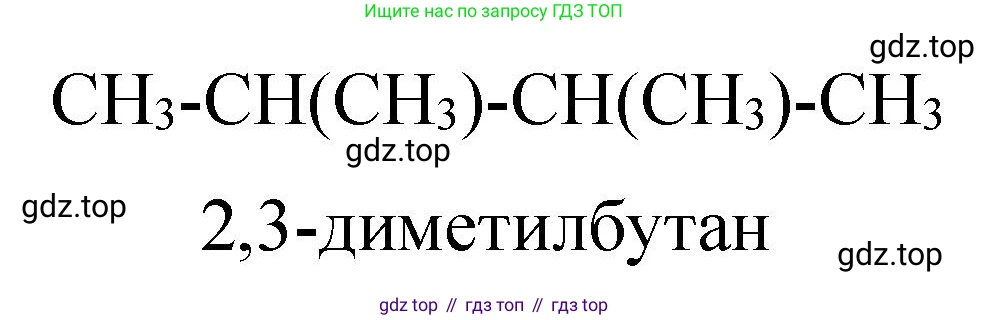
5. 2,3-диметилбутан:
$CH_3-CH(CH_3)-CH(CH_3)-CH_3$
Ответ:
Молекулярная формула углеводорода: $C_6H_{14}$ (гексан).
Изомеры гексана, их названия и структурные формулы:
1. Гексан (н-гексан): $CH_3-CH_2-CH_2-CH_2-CH_2-CH_3$
2. 2-метилпентан: $CH_3-CH(CH_3)-CH_2-CH_2-CH_3$
3. 3-метилпентан: $CH_3-CH_2-CH(CH_3)-CH_2-CH_3$
4. 2,2-диметилбутан: $CH_3-C(CH_3)_2-CH_2-CH_3$
5. 2,3-диметилбутан: $CH_3-CH(CH_3)-CH(CH_3)-CH_3$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 8 расположенного на странице 34 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 34), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.



















