Номер 1, страница 93 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава VI. Спирты и фенолы. Параграф 19. Одноатомные предельные спирты. Подумайте, ответьте, выполните... - номер 1, страница 93.
№1 (с. 93)
Условие. №1 (с. 93)
скриншот условия

1. Составьте электронные формулы метилового спирта, этилового спирта и воды. Поясните, как при перекрывании соответствующих электронных орбиталей образуются химические связи в молекуле воды и в гидроксильной группе спиртов.
Решение. №1 (с. 93)

Решение 2. №1 (с. 93)
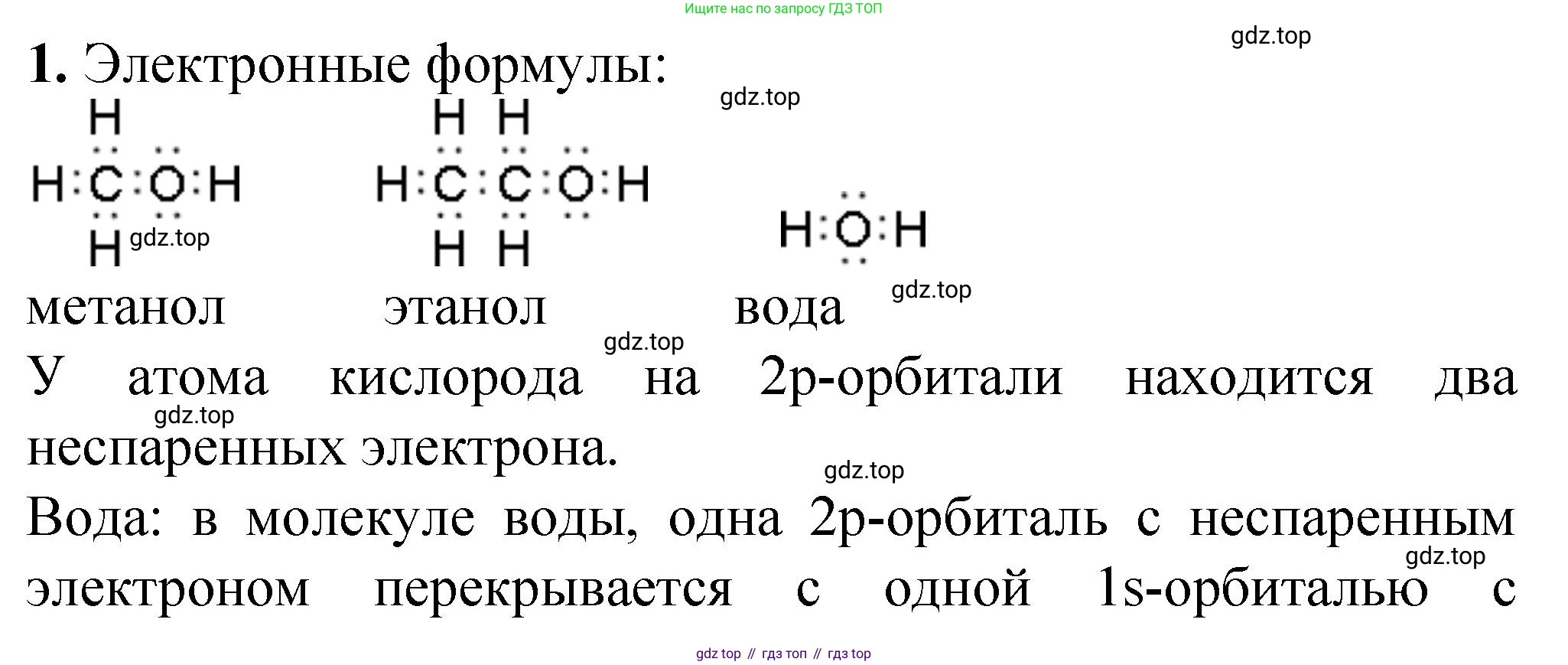
Электронные формулы метилового спирта, этилового спирта и воды
Электронные формулы, также известные как формулы Льюиса, представляют собой способ изображения молекул, при котором все валентные электроны (участвующие в образовании связей и неподеленные) показаны в виде точек. Общие электронные пары, образующие ковалентную связь, часто изображают в виде двоеточия или черточки между атомами.
Метиловый спирт (метанол, $CH_3OH$)
Атом углерода образует три связи с атомами водорода и одну с атомом кислорода. Атом кислорода, в свою очередь, связан с углеродом и водородом и имеет две неподеленные электронные пары.
Электронная формула: $H:\overset{\large H}{\underset{\Large \cdot\cdot \atop H}{C}}:\ddot{O}:H$
Этиловый спирт (этанол, $C_2H_5OH$)
Молекула содержит два атома углерода, связанных между собой. Один атом углерода связан с тремя атомами водорода, а другой — с двумя атомами водорода и атомом кислорода гидроксильной группы.
Электронная формула: $H:\overset{\large H}{\underset{\Large \cdot\cdot \atop H}{C}}:\overset{\large H}{\underset{\Large \cdot\cdot \atop H}{C}}:\ddot{O}:H$
Вода ($H_2O$)
Атом кислорода связан с двумя атомами водорода и имеет две неподеленные электронные пары.
Электронная формула: $H:\ddot{O}:H$
Ответ: Электронные формулы: метиловый спирт $H:\overset{\large H}{\underset{\Large \cdot\cdot \atop H}{C}}:\ddot{O}:H$; этиловый спирт $H:\overset{\large H}{\underset{\Large \cdot\cdot \atop H}{C}}:\overset{\large H}{\underset{\Large \cdot\cdot \atop H}{C}}:\ddot{O}:H$; вода $H:\ddot{O}:H$.
Объяснение образования химических связей в молекуле воды и в гидроксильной группе спиртов
Образование химических связей в этих соединениях объясняется методом валентных связей, который предполагает перекрывание электронных орбиталей атомов. Для объяснения геометрии молекул используется концепция гибридизации атомных орбиталей.
Молекула воды ($H_2O$)
Атом кислорода имеет электронную конфигурацию внешнего энергетического уровня $2s^22p^4$. В его валентной оболочке находятся шесть электронов, из которых два — неспаренные (на двух $p$-орбиталях). Атом водорода имеет конфигурацию $1s^1$ с одним неспаренным электроном.
Для объяснения угловой формы молекулы воды и валентного угла $104.5^\circ$ принимается, что атом кислорода находится в состоянии $sp^3$-гибридизации. Одна $2s$- и три $2p$-орбитали атома кислорода смешиваются, образуя четыре одинаковые по форме и энергии $sp^3$-гибридные орбитали, направленные к вершинам тетраэдра (с углом $109.5^\circ$ между ними).
Две из этих $sp^3$-орбиталей полностью заняты парами электронов (неподеленные электронные пары), а две другие содержат по одному электрону. Именно эти две одноэлектронные $sp^3$-орбитали кислорода перекрываются с $1s$-орбиталями двух атомов водорода. Это осевое перекрывание приводит к образованию двух прочных ковалентных полярных $\sigma$-связей $O-H$. Отталкивание между неподеленными электронными парами сильнее, чем между связывающими, поэтому валентный угол $H-O-H$ сжимается с $109.5^\circ$ до $104.5^\circ$.
Гидроксильная группа спиртов ($-OH$)
Строение гидроксильной группы в спиртах аналогично строению молекулы воды. Атом кислорода здесь также находится в состоянии $sp^3$-гибридизации.
Две $sp^3$-гибридные орбитали кислорода заняты неподеленными электронными парами. Третья $sp^3$-орбиталь перекрывается с $1s$-орбиталью атома водорода, образуя $\sigma$-связь $O-H$. Четвертая $sp^3$-орбиталь кислорода перекрывается с гибридной орбиталью атома углерода (в предельных одноатомных спиртах это $sp^3$-орбиталь), образуя $\sigma$-связь $C-O$.
Таким образом, связь $O-H$ и в воде, и в спиртах образуется в результате перекрывания $sp^3$-орбитали кислорода и $1s$-орбитали водорода. Наличие двух неподеленных пар у кислорода обусловливает угловое строение фрагмента $C-O-H$ в спиртах, где валентный угол близок к тетраэдрическому (например, в метаноле он составляет $108.9^\circ$).
Ответ: Химические связи в молекуле воды и в гидроксильной группе спиртов образуются при участии $sp^3$-гибридных орбиталей атома кислорода. В воде две $\sigma$-связи $O-H$ образуются при перекрывании двух $sp^3$-орбиталей кислорода с $1s$-орбиталями двух атомов водорода. В гидроксильной группе спирта $\sigma$-связь $O-H$ образуется за счет перекрывания $sp^3$-орбитали кислорода и $1s$-орбитали водорода, а $\sigma$-связь $C-O$ — за счет перекрывания $sp^3$-орбитали кислорода и гибридной (обычно $sp^3$) орбитали углерода. Две оставшиеся $sp^3$-орбитали кислорода заняты неподеленными электронными парами, что обуславливает угловое строение этих фрагментов молекул.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 1 расположенного на странице 93 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 93), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















