Номер 4, страница 212 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава XI. Химия полимеров. Параграф 46. Синтетические волокна - номер 4, страница 212.
№4 (с. 212)
Условие. №4 (с. 212)
скриншот условия

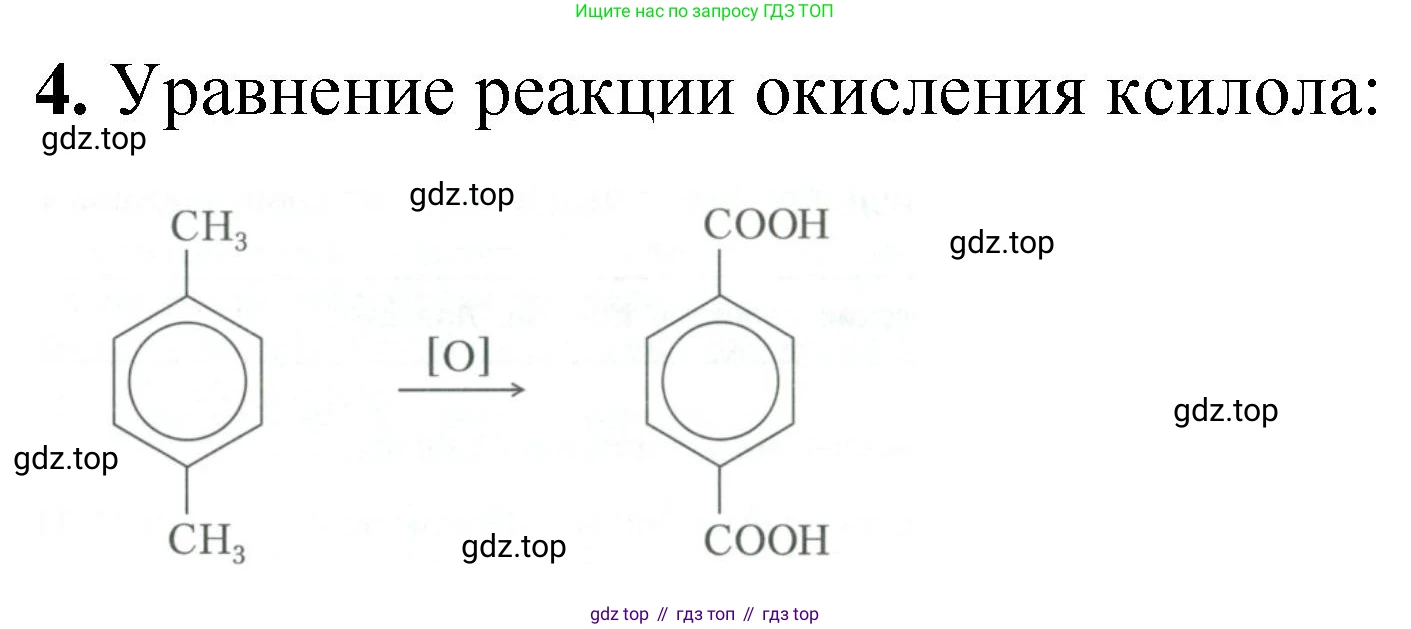
4*. Составьте уравнение реакции окисления ксилола. Для каких целей используют продукт реакции?
Решение. №4 (с. 212)
Решение 2. №4 (с. 212)
Ксилол (диметилбензол) существует в виде трёх изомеров: орто-ксилол (1,2-диметилбензол), мета-ксилол (1,3-диметилбензол) и пара-ксилол (1,4-диметилбензол). Продукты окисления ксилола зависят от исходного изомера и условий проведения реакции (тип окислителя, температура). При окислении обе метильные группы ($–CH_3$), связанные с бензольным кольцом, превращаются в карбоксильные группы ($–COOH$), образуя соответствующие дикарбоновые кислоты.
Составьте уравнение реакции окисления ксилола.
Рассмотрим окисление на примере наиболее важного в промышленном отношении изомера — пара-ксилола. Основным промышленным методом получения продукта его окисления, терефталевой кислоты, является каталитическое окисление кислородом воздуха.
1. Каталитическое окисление пара-ксилола:
Пара-ксилол окисляется кислородом воздуха в присутствии катализаторов (соли кобальта и марганца) при повышенной температуре и давлении с образованием терефталевой кислоты и воды.
$C_6H_4(CH_3)_2 \text{ (п-ксилол)} + 3O_2 \xrightarrow{кат., t, p} C_6H_4(COOH)_2 \text{ (терефталевая кислота)} + 2H_2O$
Аналогично протекают реакции окисления для других изомеров:
Окисление орто-ксилола приводит к образованию фталевой кислоты:
$C_6H_4(CH_3)_2 \text{ (о-ксилол)} + 3O_2 \xrightarrow{кат., t, p} C_6H_4(COOH)_2 \text{ (фталевая кислота)} + 2H_2O$
Окисление мета-ксилола приводит к образованию изофталевой кислоты:
$C_6H_4(CH_3)_2 \text{ (м-ксилол)} + 3O_2 \xrightarrow{кат., t, p} C_6H_4(COOH)_2 \text{ (изофталевая кислота)} + 2H_2O$
2. Окисление сильным окислителем (лабораторный метод):
В лабораторных условиях для окисления гомологов бензола часто используют сильные окислители, например, перманганат калия ($KMnO_4$) в кислой среде. Ниже приведено сбалансированное уравнение реакции для любого из изомеров ксилола:
$5C_6H_4(CH_3)_2 + 12KMnO_4 + 18H_2SO_4 \rightarrow 5C_6H_4(COOH)_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$
Ответ: Уравнение каталитического окисления пара-ксилола: $C_6H_4(CH_3)_2 + 3O_2 \rightarrow C_6H_4(COOH)_2 + 2H_2O$. Уравнение окисления пара-ксилола перманганатом калия в кислой среде: $5C_6H_4(CH_3)_2 + 12KMnO_4 + 18H_2SO_4 \rightarrow 5C_6H_4(COOH)_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$.
Для каких целей используют продукт реакции?
Продукты окисления ксилола — фталевые кислоты — являются ценным химическим сырьём с широким спектром применения.
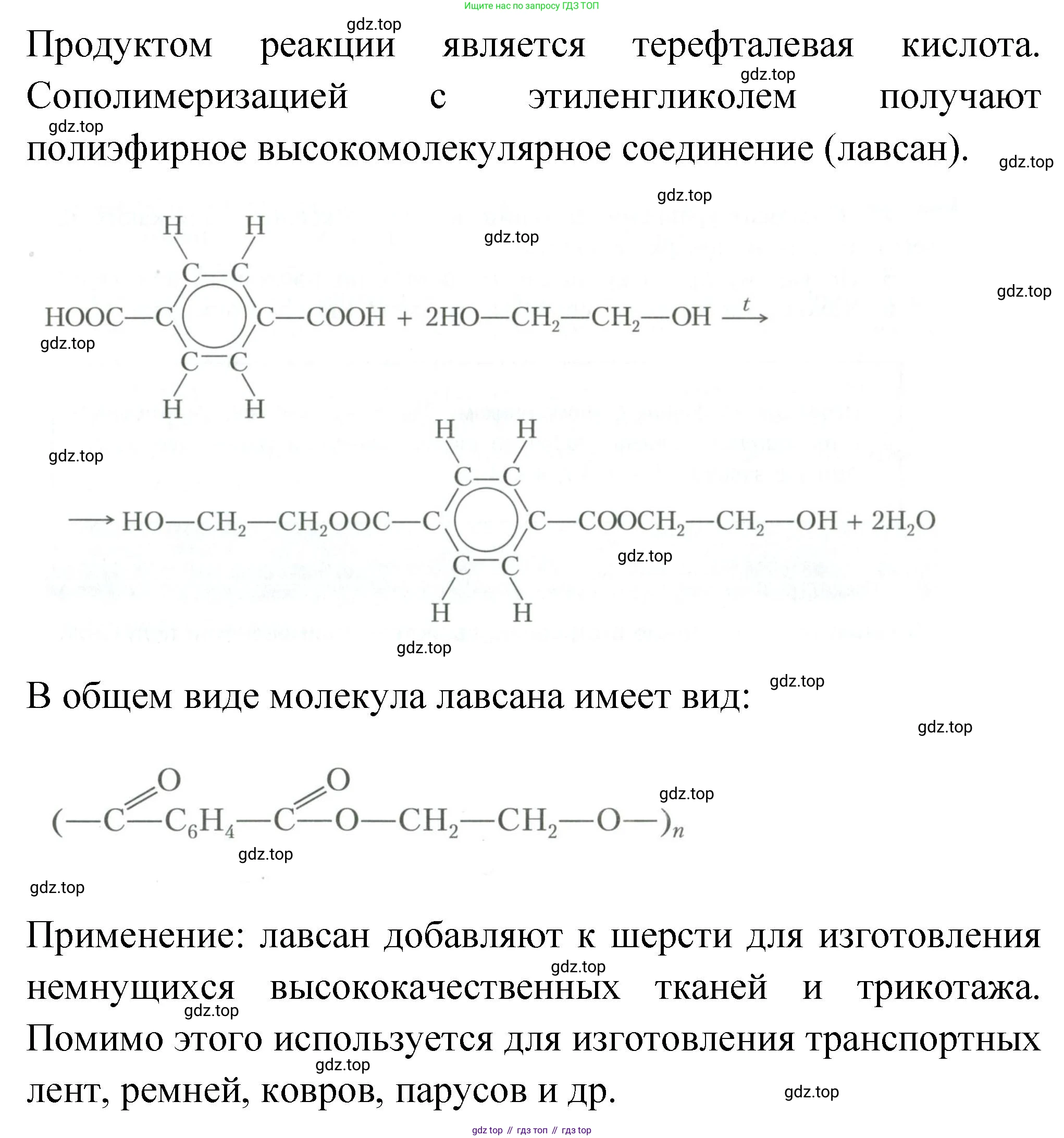
Терефталевая кислота (продукт окисления пара-ксилола) — один из самых крупнотоннажных продуктов органического синтеза. Она является мономером для производства полиэтилентерефталата (ПЭТФ, в России известен как лавсан, за рубежом — дакрон, терилен, майлар). Из ПЭТФ изготавливают:
Синтетические волокна для текстильной промышленности (ткани, одежда, ковры).
Пластиковые бутылки для напитков и пищевых продуктов.
Различные плёнки (упаковочные, для фото- и киноплёнки, для конденсаторов).
Конструкционные пластмассы.
Фталевая кислота (продукт окисления орто-ксилола) легко дегидратируется с образованием фталевого ангидрида. Фталевый ангидрид используется для синтеза:
Пластификаторов для полимеров (например, диоктилфталат), придающих гибкость и эластичность ПВХ.
Алкидных и полиэфирных смол, которые являются основой для производства лаков, эмалей и красок.
Красителей (например, индикатора фенолфталеина) и лекарственных препаратов.
Изофталевая кислота (продукт окисления мета-ксилола) используется в производстве:
Высокопрочных полимерных материалов, таких как арамидные волокна (например, Номекс), обладающие высокой термо- и хемостойкостью.
Ненасыщенных полиэфирных смол, используемых для изготовления стеклопластиков.
Ответ: Продукты реакции (терефталевая, фталевая и изофталевая кислоты) используются в основном для синтеза полимеров: полиэтилентерефталата (ПЭТФ) для производства пластиковых бутылок и синтетических волокон (лавсан), а также для производства пластификаторов, смол, красителей и высокопрочных термостойких материалов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 4 расположенного на странице 212 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 212), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















